Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Связанный биотин в роли простетической группы
Другие свойства ферментов, зависимых от биотина
Большинство зависимых от биотина карбоксилаз относится к крупным белкам. Так, протомер пируваткарбоксилазы, содержащий молекулу биотина, имеет мол. вес 410 000. В присутствии аллостерического активатора, цитрата, протомер полимеризуется с образованием «крупной формы» с мол. весом 4∙106—8∙106. От 10 до 20 протомеров ассоциируют, образуя нити длиной 400 нм и толщиной 7—10 нм. Только такая полимеризованная форма проявляет ферментативную активность. Ацетил-КоА—карбоксилаза из печени цыпленка и печени крысы обладает сходными свойствами: мономер (мол. вес 410 000) ассоциирует в полимеры с мол. весом 8∙106.
Подобно ацетил-СоА—карбоксилазе из Е. coli, транскарбоксилаза пропионовокислых бактерий является крупным (мол. вес ~ 792 000) и сложным ферментом. Молекула этого фермента состоит из 18 субъединиц и содержит 6 молекул биотина и 6 ионов металла, в число которых входят как Со2+, так и Zn2+ [12].
Недавно были обнаружены еще три зависимых от биотина фермента. Карбамоилфосфатсинтетаза Е. coli [13, 13а] необходима для синтеза пиримидинов; она катализирует следующую реакцию:
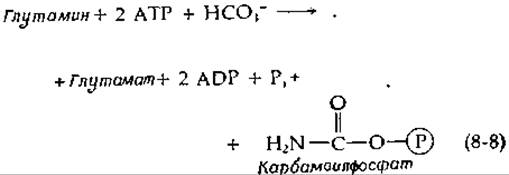
Вероятно, одна молекула АТР используется для получения карбоксибиотинового промежуточного соединения, тогда как вторая молекула фосфорилирует карбоксильную группу и, кроме того, по-видимому, способствует расщеплению амидной связи глутамина.
Дрожжи (Saccharomyces cerevisiae) не способны синтезировать биотин и нуждаются в необычно большом количестве этого витамина, если в качестве единственного источника азота для роста используется мочевина, аллантоин, аллантоиновая кислота или некоторые другие соединения. Это связано с тем обстоятельством, что, прежде чем мочевина подвергается гидролизу до NH3 и СО2, она должна быть карбоксилирована [уравнение (8-9)] при помощи биотинсодержащего фермента карбоксилазы мочевины [13]:
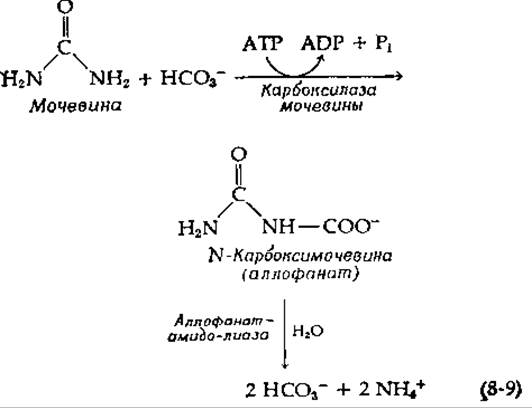
У Candida Ulis карбоксилазная и гидролазная активности принадлежат одному ферменту: амидолиазе мочевины [15].