Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Тиаминдифосфат
Пиридоксальфосфат в роли катализатора
Как пиридоксаль, так и PLP при полном отсутствии ферментов способны не только вступать в реакции переаминирования с аминокислотами, но могут и катализировать многие реакции превращений аминокислот, идентичные реакциям, катализируемым PLP-зависимыми ферментами. Таким образом, сам кофермент можно рассматривать как «активный центр» ферментов и исследовать его в модельных неферментативных реакциях. Ранние модельные исследования позволили сделать следующие выводы о PLP [34]:
а. Альдегидная группа PLP легко и обратимо реагирует с аминокислотами с образованием шиффовых оснований (рис. 8-5). Шиффовы основания реагируют далее с образованием различных продуктов.
б. Для того чтобы альдегид был катализатором, в орто- или параположении по отношению к —СНО-группе должна находиться сильная электроноакцепторная группа, например кольцевой азот пиридина (как в PLP). Нитрогруппа, которая также является сильным акцептором электронов, может замещать пиридиновый азот в модельных реакциях:
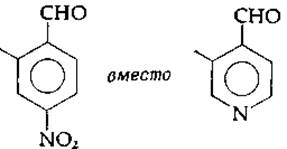
в. Наличие —ОН-группы по соседству с —СНО-группой значительно повышает каталитическую активность. Поскольку ионы некоторых металлов, например Сu2+ и Аl3+, увеличивают скорости реакций в модельных системах и, как известно, образуют хелаты (клешнеобразные аддукты) с шиффовыми основаниями, сходные с теми, которые получаются с PLP, был сделан вывод, что либо ион металла, либо протон образует хелатное кольцо и способствует стабилизации плоскостной конформации шиффова основания (рис. 8-5)
г. В модельных системах 5-оксиметильная и 2-метильная группы для катализа не существенны. В то же время в ферментах 5-СН2—ОН-группа необходима для прикрепления фосфатной «ручки». Теперь уже известно, что у многих PLP-ферментов 2—СН3-группа не является необходимой для коферментной активности.
1) Однако у PLP-зависимых ферментов такая функция ионов металла не обнаружена.
Дополнение 8-Е
Нингидрин
Важный аналитический реагент, применяемый в биологических исследованиях, нингидрин (моногидрат индан-1,2,3-триона), подобно пиридоксальфосфату образует с аминокислотами реакционноспособные шиффовы основания (кетимины). Декарбоксилирование кетаминов с последующим гидролизом образующихся альдиминов приводит к промежуточному амину, который может реагировать со второй молекулой нингидрина, давая характерное пурпурное Окрашиваниеa:
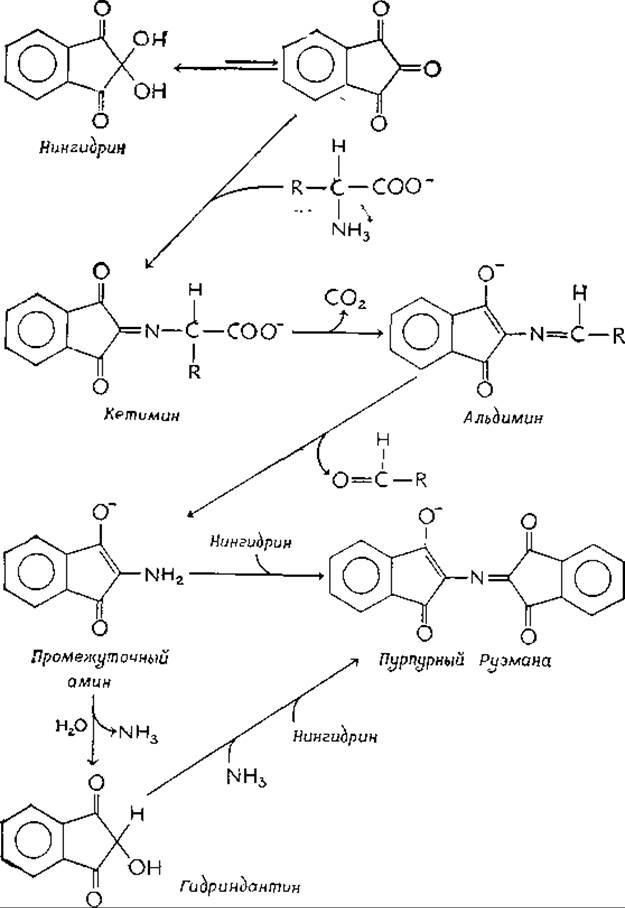
Эта реакция широко используется в хроматографии и для количественного определения аминокислот (гл. 2, разд. 3,5). а-Аминокислоты реагируют в большинстве случаев легко, однако первичные амины и пептиды также образуют пурпурный краситель Руэманна. При этом из кетимина отщепляется не СО2, а протон. Если в реакцию вступает пиридоксамин, то на хроматограммах появляется ярко оранжевый продукт, вероятно альдимин. Вторичные амины, например пролин, дают желтую окраску.
Промежуточный амин может гидролизоваться до свободного аммиака. Для обеспечения максимального развития окраски в растворы нингидрина, предназначенные для количественного анализа, обычно добавляют гидриндантин (восстановленный нингидрин), который может реагировать со свободным NH3 и нингидрином с образованием пурпурного Руэманна (см. схему).
Как нингидриновая реакция, так и катализируемое пиридоксальфосфатом декарбоксилирование аминокислот являются примерами деградации, описанной Штрекером. В 1862 г.
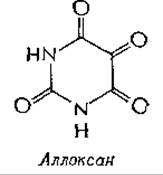
Штрекер сообщил, что аллоксан вызывает декарбоксилирование аланина до ацетальдегида, СО2 н аммиакаб. Многие другие карбоксильные соединения, например соединения с общей структурой и n-нитросалициловый альдегид, также вызывают штрекеровскую деградациюв.
![]()
а Friedman М, Williams L. D. (1974). Bioorganic Chem, 3, 267—280,
б Strecker А (1862) Annalen, 123, 363—365
в Schonberg A, Moubacher R. (1952) Chem. Rev., 50, 261—277.