Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Тиаминдифосфат
Основная функция пиридоксальфосфата
Рассмотрев различные известные PLP-зависимые ферменты, ответственные за метаболизм аминокислот, Браунштейн и Шемякин [35] в 1953 г. высказали предположение об общем механизме их действия. Предложенная ими теория находилась в полном согласии с результатами тогда еще неопубликованных модельных экспериментов, о которых упоминалось выше, и в дальнейшем получила полное подтверждение в исследованиях большого числа ферментов.
Общий механизм действия PLP можно упрощенно сформулировать следующим образом пиридоксальфосфат замещает — NН2-группу (или —NH+3-группу) аминокислот-субстратов на группу, которая по электронным свойствам эквивалентна смежной карбонильной группе. Это происходит в результате образования шиффова основания (рис. 8-5). Заметим, однако, что полярность шиффова основания, образованного аминокислотой с простым альдегидом (например, с ацетальдегидом), противоположна полярности группы С = О:
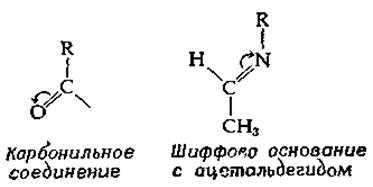
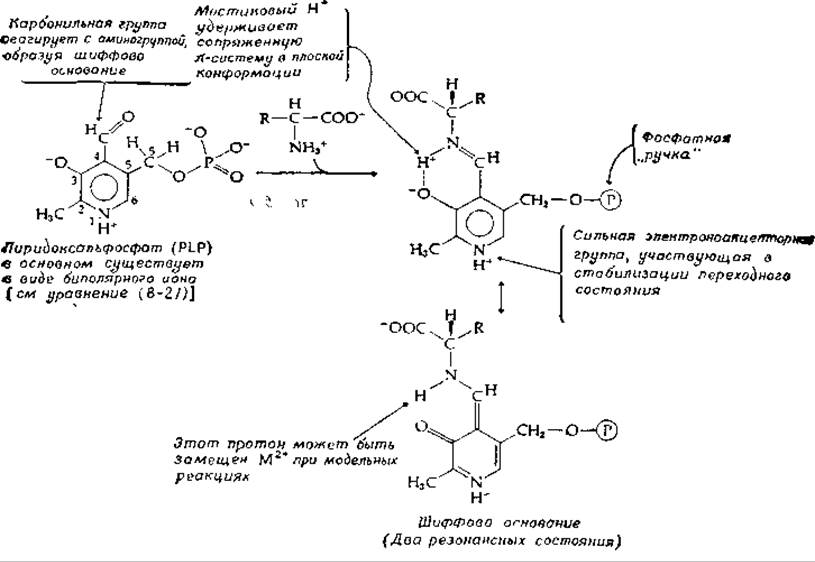
РИС. 8-5. Пиридоксаль-5'-фосфат (PLP) — специальный кофермент реакций превращения аминокислот.
Такой имин не может заменить карбонильную группу в активации а-водорода или в облегчении расщепления связи С—С в аминокислоте. Для этого необходимо наличие сильной электроноакцепторной пиридиновой группы, сопряженной с C=N-гpyппа, так чтобы электроны могли перемещаться от субстрата на кофермент (рис. 8-6).
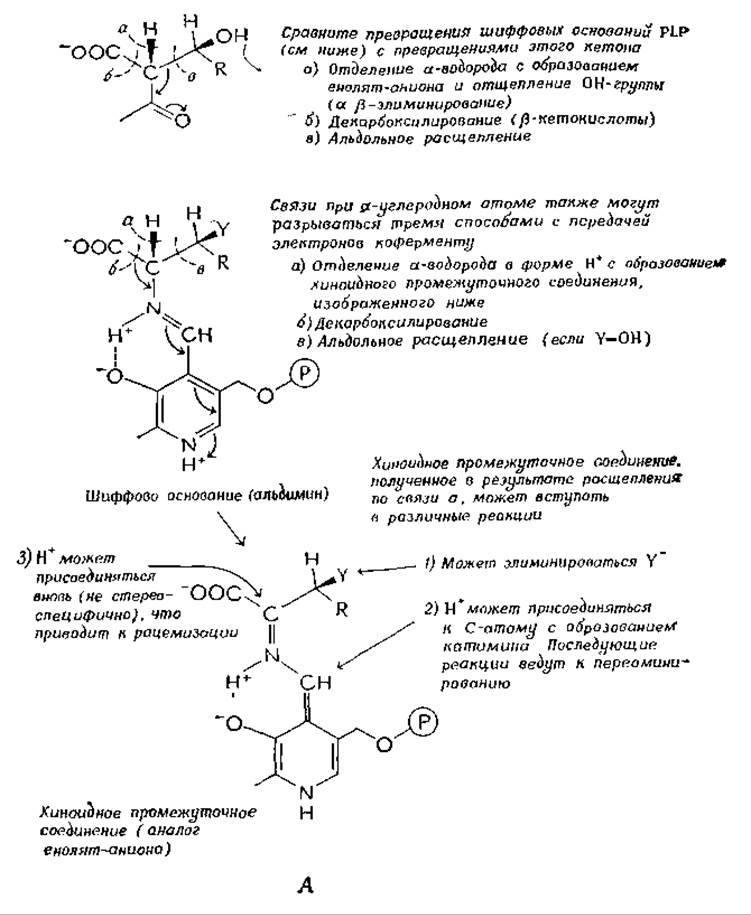
Превращения шиффовых оснований, образуемых PLP и аминокислотами, можно сопоставить с превращениями ß-кетокислоты, как показано на рис. 8-6. Эти реакции можно подразделить на три группы (а, б и в) в зависимости от местоположения разрываемой связи (между а-углеродом субстрата, с одной стороны, и атомом водорода, или карбоксильной группой, или боковой цепью — с другой). Четвертая группа реакций г включает также отщепление а-водорода, но механизм этих реакций сложнее, чем механизм реакций группы а.
а. Диссоциация а-водорода
Отщепление а-водорода в шиффовом основании PLP приводит к образованию хиноидного промежуточного соединения, превращения которого, подобно превращениям енолят-аниона, могут пойти по различным путям (рис. 8-6,А).
1. Элиминирование. Если в ß-положении аминокислоты имеется хорошая уходящая группа, то она может быть элиминирована (рис. 8-6, Б) [36]. Ферменты, катализирующие реакции этого типа, многочислены. К ним относятся серин- и треониндегидратазы (элиминирование ОН- в форме Н2О), триптофаназа бактерий (элиминирование индола) и аллииназа лука и чеснока (элиминирование 1-пропенилсульфеновой кислоты, слезоточивого вещества, образующегося при измельчении лука и чеснока).
Реакции ß-замещения катализируются такими ферментами, как триптофансинтетаза (гл. 14, разд. И,3) и цистеинсинтетаза (гл. 14, разд. Ж), существенными для биосинтеза аминокислот. Шиффовы основания кофермента и ненасыщенных аминокислот, обычно аминоакрилата или аминокротоната, могут быть промежуточными продуктами при элиминировании, а также при ß-замещении (рис. 8-6, Б). Согласно существующим представлениям, превращение в конечные продукты происходит путем гидролиза до свободного аминоакрилата, таутомеризации в аминокислоту и гидролиза последней до пирувата и аммоний-иона (рис. 8-6, 5). Имеются, однако, сообщения, например [37], о стереоспецифическом присоединении протона к ß-углеродному атому а-кетобутирата. Следовательно, при желании читатель может поразмышлять о возможных путях распада шиффова основания ненасыщенной аминокислоты, указанного на рисунке 8-6, Б [см. также схему (8-28)].
2. Переаминирование. Протон может присоединяться к углеродному атому, связанному с положением 4 кольца PLP (рис. 8-6, В), с образованием вторичного шиффова основания, которое часто называют РМР-кетимином. Последний способен легко гидролизоваться до пиридоксаминфосфата (РМР) и а-кетокислоты. Этот ряд превращений представляет собой одну из двух полуреакций [уравнения (8-17) и (8-18)], необходимых для ферментативного переаминирования:
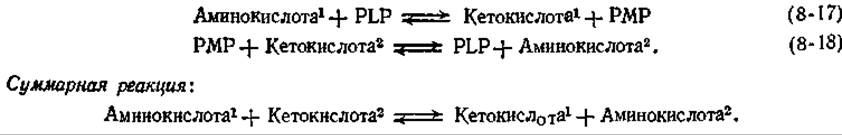
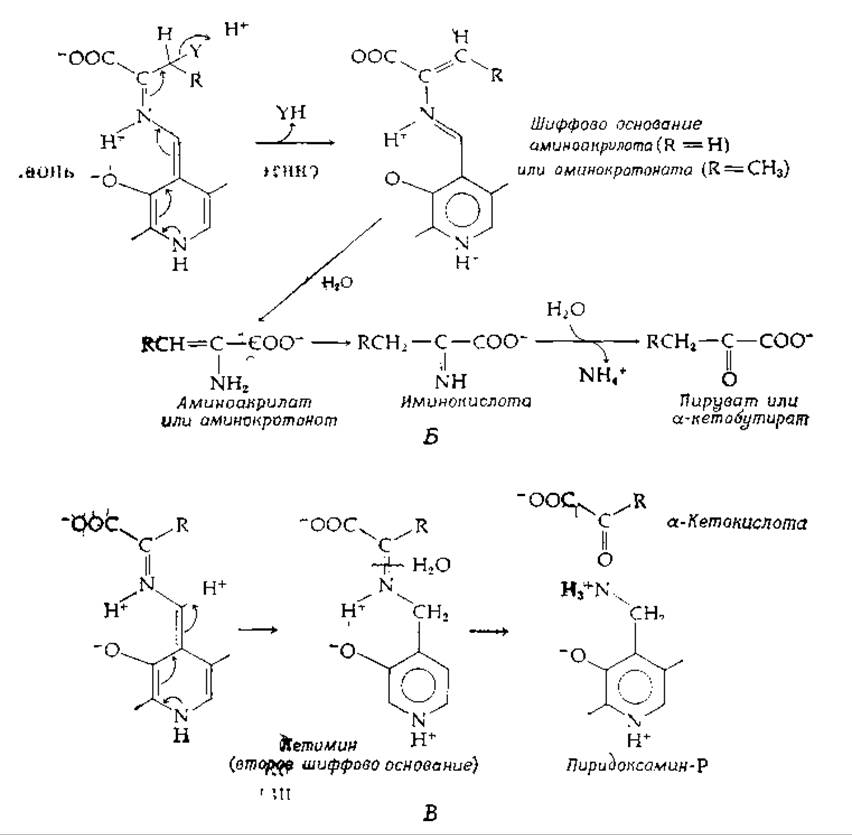
РИС. 8-6. Некоторые реакции шиффовых оснований пиридоксальфосфата (реакции типа 8 в табл 9-1). А. Образование хиноидного промежуточного соединения Б. Элиминирование ß-заместителя В. Переаминирование.
Трансаминазы играют в метаболизме аминокислот чрезвычайно важную роль; в настоящее время известно более 50 различных ферментов этого класса [33]. Наиболее изученный из них — это цитоплазматическая аспартатаминотрансфераза из сердечной мышцы свиньи — димерный фермент, состоящий из субъединиц с мол. весом 46 344 (рис. 2-1).
Митохондриальный изофермент по своим свойствам несколько отличается от цитоплазматического.
3. Рацемизация. Протон может быть вновь присоединен в исходное a-положение, но уже иестереоспецифично. Рацемазы, катализирующие реакции этого типа, имеют важное значение для бактерий, которые должны синтезировать из соответствующих L-изомеров D-аланин и D-глутаминовую кислоту, необходимые для синтеза пептидогликанов.
б. Декарбоксилирование
Связь между а-С-атомом и карбоксильной группой (но не связь между этим атомом и а-водородом) может быть разорвана (рис. 8-6, Л). Эта реакция, катализируемая декарбоксилазами аминокислот, также приводит к образованию хиноидного промежуточного соединения. Последовательность стадий завершается присоединением протона в пункте отщепления карбоксила с последующим распадом шиффова основания. Декарбоксилирование аминокислот — процесс практически необратимый и часто является конечной стадией биосинтеза аминосоединений.
Например, в мозге глутаминовая кислота декарбоксилируется до у-аминомасляной кислоты, а 3,4-диоксифенилаланин (ДОФА) —до дофамина. Гистидин превращается в гистамин. У бактерий лизин образуется путем декарбоксилирования мезо-диаминопимелиновой кислоты (гл. 14, разд. Г,2), а фосфатидилэтаноламин — путем декарбоксилирования фосфатидилсерина (гл. 12, разд. Е,2).
в. Расщепление боковой цепи аминокислот
В реакциях, относящихся к третьему типу, боковая цепь шиффова основания, изображенного на рисунке 8-6, А, может отщепиться в результате реакции альдольного расщепления. И напротив, боковая цепь может присоединяться путем реакции ß-конденсации. Наиболее изученным из ферментов, катализирующих отщепление боковой цепи, является серинтрансоксиметилаза, превращающая серин в глицин и формальдегид [37]1). Последний не высвобождается в свободном виде, а переносится тем же ферментом избирательно на тетрагидрофолиевую кислоту с образованием циклического аддукта [уравнение (8-69)].
![]()
Треонин расщепляется тем же ферментом до ацетальдегида. Еще одна реакция этого типа приведена в верхней части рис. 14-27.
1) В последние годы получены данные, доказывающие идентичность этого фермента, называемого также серин — оксиметилтрансферазой, с аллоферментами треонин — альдегид-лиазой и фенилсерин—альдегид-лиазой макроорганизмов и животных клеток. — Прим. ред.
В результате двух реакций сложноэфирной конденсации ацильные группы производных СоА переносятся на шиффовы основания глицина или серина. Сукцинил-СоА служит донором ацильного остатка в биосинтезе δ-аминолевулиновой кислоты, промежуточного соединения Е синтезе гемов (гл. 14, разд. Е,4):
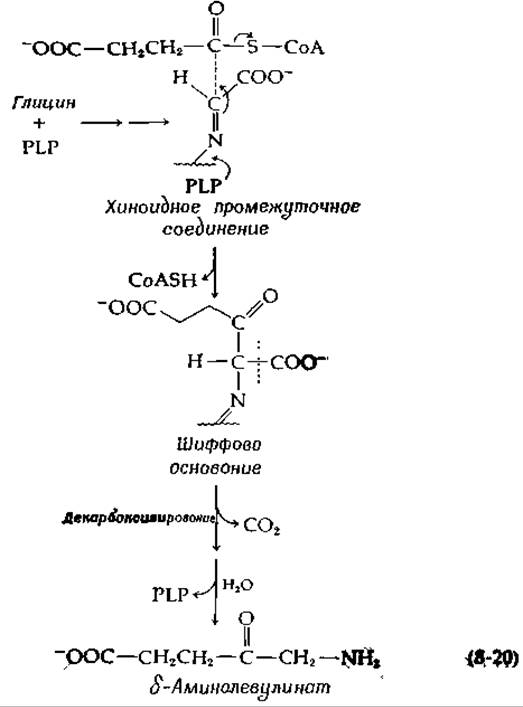
Поскольку в отсутствие сукцинил-СоА фермент не катализирует декарбоксилирования глицина, по-видимoму, декарбоксилирование происходит после конденсации [уравнение (8-20)] [39].
В биосинтезе сфингозина [уравнение (12-24)] серин конденсируется (также в сочетании со стадией декарбоксилирования) с пальмитоил-СоА с промежуточным образованием аминокетона [40]:
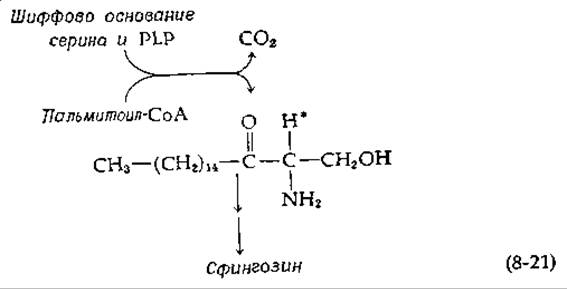
Показано, что атом водорода, отмеченный на схеме звездочкой, первоначально является а-водородом серина. Таким образом, в этом случае декарбоксилирование, по-видимому, предшествует конденсации.
г. Хиноидное производное в роли акцептора электронов
Согласно существующим представлениям, в PLP-зависимых реакциях четвертого типа участвует либо хиноидное промежуточное соединение, либо кетимин, изображенный на рис. 8-6, В. В обоих этих соединениях отсутствует исходный а-водород аминокислоты, а связь. C = NH+поляризована в направлении, способствующем оттягиванию электронов от аминокислоты к коферменту. Это обеспечивает осуществление целого ряда реакций, аналогичных реакциям превращения ß-кетокислот. Происходит как элиминирование, так и расщепление связи С—С по а- и ß-положениям (относительно С = N-группы) хиноидного (или кетиминного) производного.
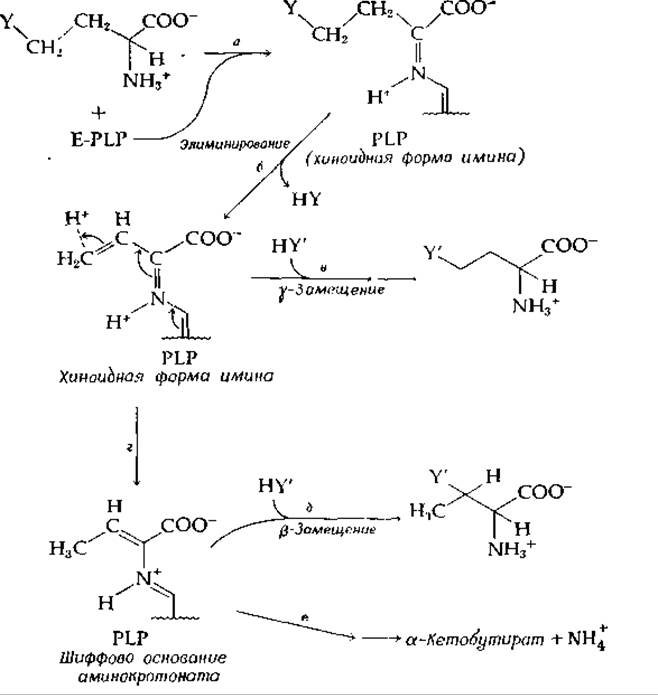
РИС. 8-7. Некоторые PLP-зависимые реакции, включающие элиминирование у-заместителя. Может происходить как его замещение другим у-заместителем, так и дезаминирование до а-кетокислоты.
Среди ферментов этого типа есть такие, которые катализируют элиминирование у-заместителя аминокислоты (рис. 8-7). Элиминируемая группа иногда замещается другим заместителем либо в у-, либо в ß-положении. В образующемся первоначально хиноидном производном происходит элиминирование у-заместителя (ß по отношению к C = N-гpyппe) наряду с элиминированием протона в ß-положении исходной аминокислоты [36] (рис. 8-7, стадии а и б). Полученное промежуточное соединение может вступать в любую из трех реакций в зависимости от природы действующего в данном случае фермента. Присоединение HY приводит к у-замещению (стадия в), тогда как присоединение протона в у-положение (на рисунке отмечено стрелками) приводит в соответствии со стадией г к образованию а,β-ненасыщенного шиффова основания. Последнее может вступать в реакцию присоединения HY (ß-замещение, стадия д) или расщепляться до а-кетокислоты и аммоний-иона (стадия е) так же, как это происходит в реакциях ß-элиминирования, показанных на рис. 8-6, Б. Важной реакцией у-замещения является превращение О-сукцинилгомосерина в цистатионин [уравнение (8-22)]:
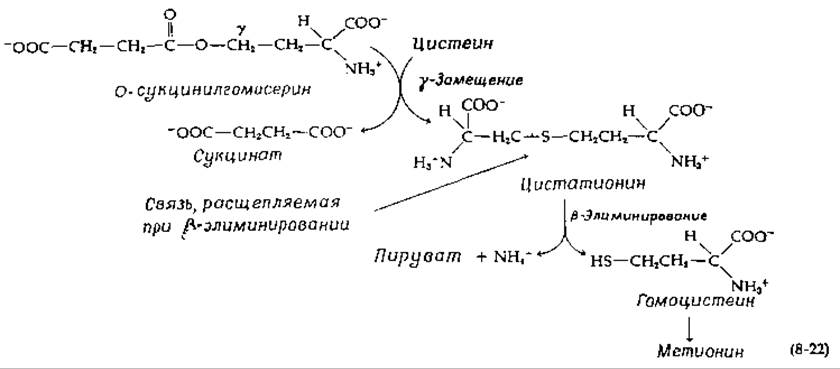
Эта реакция входит в путь биосинтеза метионина в клетках Salmonella. Цистатионин далее подвергается ß-элиминированию с образованием гомоцистеина, который затем превращается в метионин [уравнение (8-85)]. В аналогичном пути биосинтеза у грибов и высших растений используется О-ацетилгомосерин. Треонин образуется из О-фосфорилгомосерина в результате у-элиминирования с последующим замещением ОН-группой в ß-положении. Эта реакция катализируется треонинсинтетазой (рис. 14-6).
Отщепление ß-карбоксильной группы в виде СО2 также может происходить через хиноидный промежуточный комплекс. Хорошо известным примером служит бактериальная аспартат—ß-декарбоксилаза [41], превращающая аспартат в аланин и СО2. Аналогичная реакция, превращение аминокислоты кинуренина в аланин и антраниловую кислоту (рис. 14-26), вероятно, требует гидратации карбонильной группы перед стадией ß-расщепления:
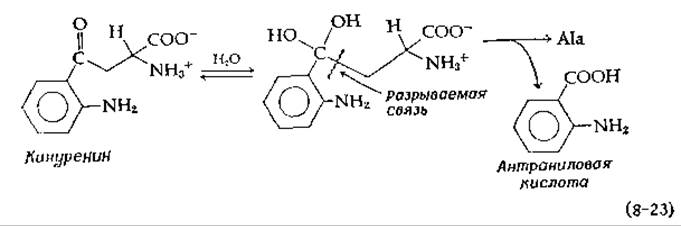
Аналогичным тиолитическим расщеплением является реакция СоА с 2-амино-4-кетопентаноатом с образованием ацетил-СоА и аланина [42].
д. Загадка гликогенфосфорилазы
Пиридоксальфосфат идеально приспособлен для катализа реакции аминосоединений. Поэтому его обнаружение в роли необходимого кофактора гликогенфосфорилазы (гл. 7 разд. В, 5) вызвало удивление. Кофермент связан с фосфорилазой в основном так же, как и в случае трансаминазы (разд. Д, 6), но функция его не ясна [43]. Поразительным является тот факт, что, по имеющимся данным, 50% всего количества витамина В6 в организме находится в виде PLP в составе мышечной фосфорилазы [44]. Из исследований, проведенных на крысах с недостаточностью витамина В6, следует, что PLP в фосфорилазе может служить резервным источником, значительная часть которого при недостаточности витамина В6 может расходоваться на другие цели.
Помимо своей функции кофермента, PLP выступает в роли специфического ингибитора и, возможно, аллостерического эффектора в отношении ряда ферментов различных классов (к ним относятся, например, альдолаза, глутаматдегидрогеназа и гексокиназа). PLP избирательно связывается также со многими другими белками [45].