Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Тиаминдифосфат
Пиридоксаминфосфат в роли кофермента
Если PLP является специфичным кофактором, предназначенным для реакций с аминогруппами субстратов, то не может ли пиридоксаминфосфат (РМР) функционировать в роли кофермента в реакциях превращения карбонильных соединений? Первый пример подобной функции РМР был обнаружен в реакции образования 3,6-дидезоксигексоз, необходимых для синтеза антигенов поверхности бактериальных клеток [46] (рис. 5-8). Глюкоза (в форме цитидиндифосфатглюкозы, или CDP-глюкозы) сначала превращается в 4-кето-6-дезокси-СDР-глюкозу. Ее превращение в 3,6-дидезокси-СDР-глюкозу требует пиридоксаминфосфат наряду с восстанавливающим агентом (NADH или NADPH):
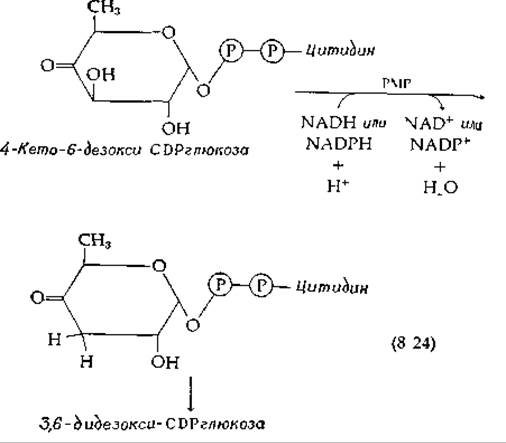
Было бы очень полезно, если бы студент, работающий над данным разделом, самостоятельно предложил механизм этой реакции, принимая во внимание ожидаемый прямой перенос водорода от NADH, как указано в разд. Ж.
Дополнение 8-Ж
Яды: антагонисты PLP-зависимых ферментов
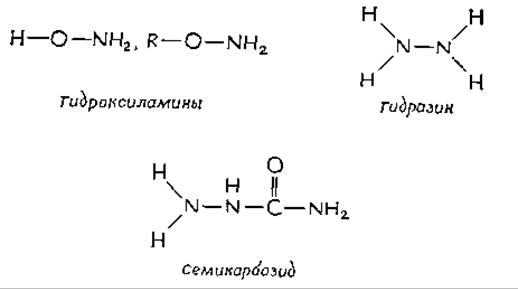
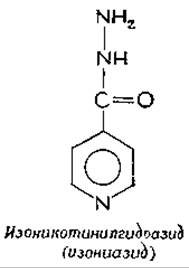
Множество ядовитых веществ, так же как и полезных лекарственных препаратов, реагирует с PLP-зависимыми ферментами. Так, токсическое действие «карбонильных реагентов» (гидроксиламинов, гидразина и семикарбазида) в значительной мере обусловлено образованием ими устойчивых производных PLP, аналогичных шиффовым основаниям. Изоникотинилгидразид (изониазид) (одно из наиболее эффективных лекарственных веществ против туберкулеза) подавляет главным образом активность пиридоксалькиназы, фермента, который катализирует превращение пиридоксаля в PLP. По-видимому, это вещество реагирует с пиридоксалем с образованием гидразона, который блокирует ферментa. Содержание пиридоксалькиназы в микобактериях очень низкое, и блокирование фермента эффективно подавляет их рост. Однако при длительном лечении изоникотинилгидразидом у больных иногда проявляются симптомы недостаточности витамина В6.
Другой противотуберкулезный препарат, антибиотик из стрептомицетов, D-циклосерин (оксамицин) по своей структуре напоминает D-аланин и является мощным ингибитором аланинрацемазы. Он ингибирует также АТР-зависимую D-алаиил-О-аланин — синтетазу, необходимую для биосинтеза пептидоглюкана стенок бактериальной клетки (дополнение 7-Г)б, которая не принадлежит к PLP-зависимым ферментам.
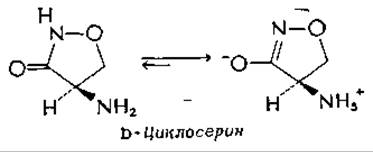
Синтетический изомер, L-циклосерин, токсичен для людей и ингибирует многие PLP-зависимые ферменты. Это наблюдение побудило Хомутова и др. к синтезу ряда замещенных производных циклосериновв, в том числе двух «циклоглутаматов»:
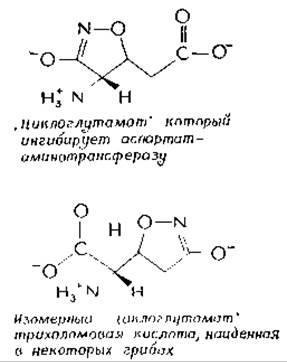
Один из них сильно взаимодействует с аспартатаминотрансферазой, в то время как другой специфически ингибирует глутаматдекарбоксилазу Е. coliг. Эти соединения можно рассматривать как структурные аналоги глутаминовой кислоты с закрепленной конформацией (см. также гл. 6, разд. Г,1). По-видимому, природа опередила химиков-синтетиков: было обнаруженод, что гриб Tricholoma muscarium содержит это же соединение, «трихоломовую кислоту». Авторы работы пишут, что оно наделило этот гриб двумя интересными свойствами: приятным запахом и смертоносным действием на мух, когда они садятся на него.
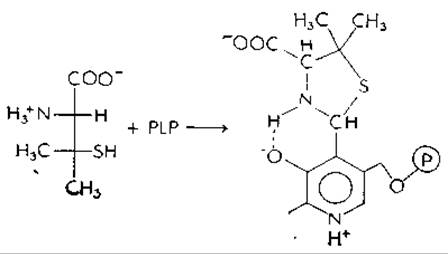
Замещенное производное цистеина, L-пенициламин, вызывает судороги и снижение уровня глутаматдекарбоксилазы в мозге, вероятно, вследствие того что шиффово основание, образованное им и PLP, может далее подвергаться циклизации, причем —SH-группа присоединяется к группе С—N с образованием устойчивого тиазолидинового цикла:
Токсопиримидии — спирт, полученный из пиримидиновой части молекулы тиамина, — является структурным аналогом пиридоксаля. При скармливании его крысам или мышам он вызывает приступы двигательного возбуждения, которые можно остановить введением витамина В6. Полагают, что фосфорилирование токсопиримидина пиридоксалькиназой приводит к аналогу, являющемуся антагонистом по отношению к PLP. Аналогичным образом 4-дезоксипиридоксин вызывает гибель цыплят, а также судороги и другие симптомы недостаточности витамина В6 у человека (испытания проводились на людях в надежде на то, что это соединение окажется хорошим противораковым лекарством). Получено множество синтетических производных PLP; часть из них эффективно блокирует PLP-зависимые ферментые,ж.
а Snell Е. Е., Haskell В. Е. (1970). Compr. Biochem., 21, 47—71.
б Gaie Е. F., Cundliffe E., Reynolds P. E., Richmond M. H., Waring M. I. (1972). The Molecular Basis of Antibiotic Action, p. 61—71, Wiley, New York.
в Хомутов P. M., Ковалева Г. К, Северин Е. С., Вдовина Л. В. (1967). Биохимия, 32, 900—907.
г Sastchenko L. Р., Severin Е. S., Metzler D. Е., Khomutov R. М. (1971). Biochemistry, 10, 4888—4894.
д Iwasaki Н., Kamiya ТOka О., Veyanagi J. (1969). Chem. Pharm. Bull., 17, 866—872.
e Snell E. E. (1970). Vitam. Horm. (N. Y.), 28, 265—290.
ж Korytnyk W., Ikawa M. (1970). In: Methods in Enzymology (D. B. McCormick, L. D. Wright, eds.), vol. 18A, p. 524—566. Academic Press, New York