Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Тиаминдифосфат
Стереохимия PLP - зависимых ферментов
В 1966г. Данатан постулировал, что разрываемая PLP-зависимым ферментом связь в аминокислоте-субстрате должна быть расположена в плоскости, перпендикулярной плоскости п-системы субстрат-коферментного имина (рис. 8-8). Такая ориентация снижает до минимального значения энергию переходного состояния, поскольку она допускает максимально возможное σ—п-перекрывание разрываемой связи и сопряженной я-системы имина кофактора. При этом, кроме того, достигается геометрия, наиболее близкая к формулируемому планарному хиноидному производному, что сводит к минимуму молекулярные перемещения при подходе к переходному состоянию [47]. На рис. 8-8 показаны три типа ориентации аминокислоты, в которых а-водород, карбоксильная группа и боковая цепь соответственно находятся в положении, оптимальном для расщепления связи. Для каждого представленного типа ориентации поворот аминокислоты на 180° приводит к другой конформации, которая также пригодна для расщепления указанной связи.
Концепция Данатана объясняет некоторые побочные реакции, наблюдаемые у PLP-зависимых ферментов, и нашла подтверждение в экспериментах Бейли с сотрудниками при исследовании а-диалкиламинотрансферазы, выделенной из почвенных бактерий [48]. Этот фермент обычно катализирует в качестве одной полуреакции сочетанную реакцию декарбоксилирования — переаминирования:
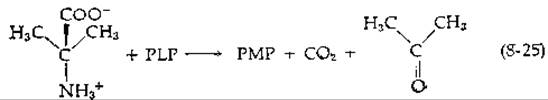
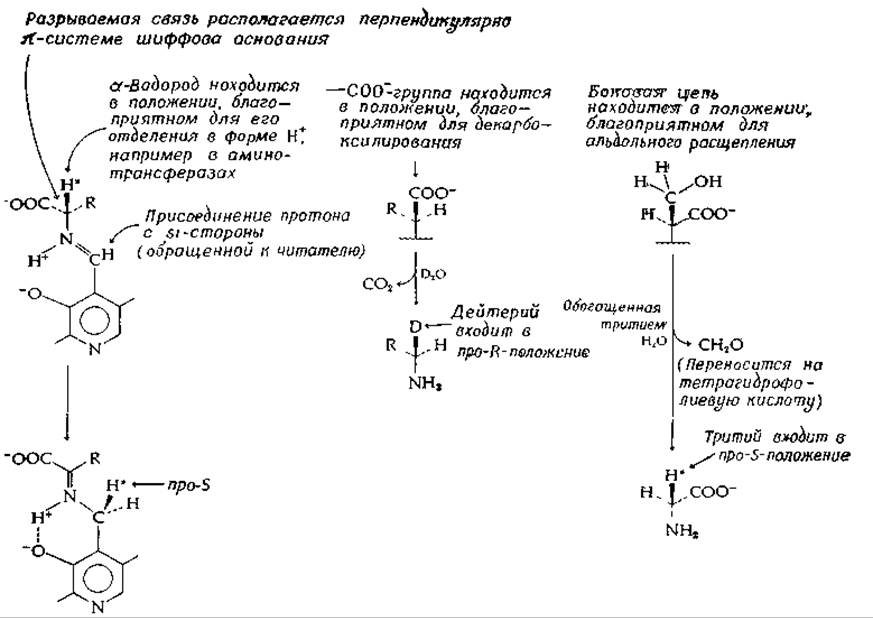
РИС. 8-8. Стереохимические аспекты катализа PLP-зависимыми ферментами.
Этот фермент действует также на D- и L-аланин: причем, декарбоксилируя D-аланин, у L-аланина он катализирует только диссоциацию а-водорода. Этим данным можно дать разумное объяснение, если исходить из предположения, что фермент обладает определенным якорным центром для одной алкильной группы, тогда как место второй алкильной группы может быть занято а-водородом или карбоксилат-ионом, и что лабилизуемая группа расположена перпендикулярно п-системе:
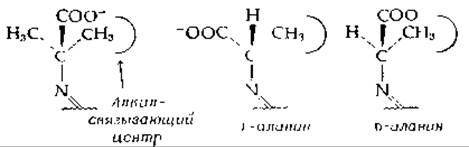
Глицин не является субстратом для этого фермента; из этого следует, что для катализа необходимо заполнение алкилсвязывающего центра.
Если концепция Данатана справедлива в отношении аминотрансфераз, то существуют только две приемлемые конформации аминокислотного субстрата; одна из них показана на рис. 8-8. В другой конформации аминокислота повернута на 180°, так что а-водород располагается позади плоскости листа бумаги. Данатан избрал для исследования пиридоксамин : пируват — аминотрансферазу, фермент родственный PLP-зависимым аминотрансферазам, но для которого субстратами являются пиридоксамин и пиридоксаль1):
![]()
Используя в качестве субстратов пиридоксаль и L-аланин, содержащий дейтерий (2Н) в а-положеиии, он доказал наличие прямого переноса а-водорода аминокислоты в 4'-положение образующегося пиридоксамина (на рис. 8-8 отмечено звездочками). Далее было показано, что 2Н включался избирательно в про-5-положение 4'-углерода пиридоксамина. Эти результаты позволяют предположить, что какая-то группа белка отрывает протон из a-положения аминокислоты и переносит его по той же поверхности п-системы (син-перенос), присоединяя его к si-стороне С = N-группы. Данатан сделал вывод, что ориентация аминокислотного субстрата совпадает с изображенной на рис. 8-8.
Согласно другим экспериментам, восстановление натрийбортритидом (NaB3H4) как альдимина, так и кетимина, образованных субстратами этого фермента, также происходит с si-стороны, свидетельствуя, по-видимому, о том, что данная сторона обращена к доступной взаимодействиям поверхности.
Декарбоксилирование аминокислот в 2Н2О приводит к включению 2Н в про-R-положение — положение, первоначально занимаемое карбоксильной группой (рис. 8-8). Расщепление серина сериноксиметилазой в воде, содержащей 3Н, приводит к включению 3Н в пpo-S-положение. Отмечено также стереоспецифическое введение 2Н или 3Н в ß-положение а-кетобутирата, получаемого в реакциях ß- или у-элиминирования. Превращение серина в триптофан, катализируемое триптофансинтетазой, происходит без инверсии при С-3 [49].
1) Реакция (8-26) каталязируется также апоферментом аспартатаминотрансферазы, причем наблюдается такой же прямой стереоспецифический перенос протона, как и в случае пиридоксамин:пируват аминотрансферазы [47]. Предполагается, что те же результаты могли бы быть получены и с пиридоксальфосфатом.