Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Тиаминдифосфат
Наблюдаемые изменения оптических свойств кофермента
Примечательно, что многие коферменты обладают способностью к поглощению света (см. гл. 13). Это свойство проявляется в виде спектра поглощения и может также сопровождаться круговым дихроизмом и флуоресценцией. Оптические свойства коферментных форм витамина В6 особенно чувствительны к изменениям окружающей среды и состояния ионизации различных групп в молекуле. Так, например, РМР в нейтральной биполярной ионной форме, которая преобладает при pH 7, имеет три полосы сильного поглощения света, центры которых находятся при 327, 253 и 217 нм [50].
Большинство различных ионных форм производных витамина В6 имеет три полосы поглощения, расположенные примерно в одних и тех же областях, однако положение и интенсивность полос для отдельных форм различны. Например, минорный таутомер РМР, содержащий незаряженное кольцо, имеет низкоэнергетическую (длинноволновую) полосу при 283 нм [уравнение (8-27)]:
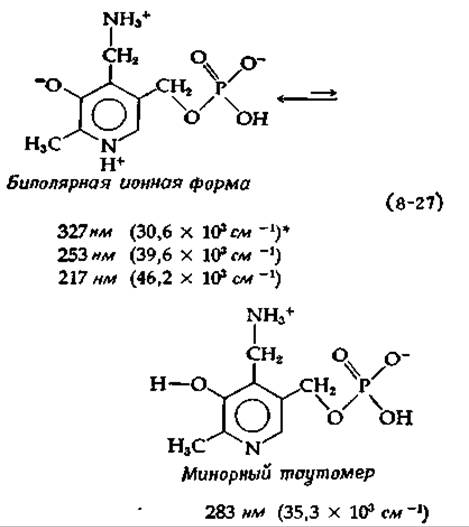
* Положения полос поглощения даны и в нанометрах н в волновых числах. Волновое число ![]() в см-1 равно 107, деленному на длину волны в нанометрах (см. гл. 13).
в см-1 равно 107, деленному на длину волны в нанометрах (см. гл. 13).
Когда протонированы и азот кольца, и фенольный кислород, полоса поглощения смещается к 294 нм (34,0∙103 см-1), а если обе группы депротонированы, то образующийся анион поглощает при 312 нм (21,1∙103 см-1). Таким образом, изучение спектра поглощения кофермента, связанного в комплексе с ферментом, может дать ответ на вопрос о том, протонированы или депротонированы те или иные группы. Например, пик связанного РМР при 330 нм в аспартатаминотрансферазе (рис. 8-9) указывает на присутствие биполярной ионной формы [уравнение (8-27) 1).
Пиридоксальфосфат представлен равновесной смесью альдегидной и гидратированной альдегидной форм [как в уравнении (7-35)]. Альдегид имеет желтую окраску и поглощает при 390 нм (25,6∙103 см-1, рис. 8-9), тогда как гидрат альдегида поглощает примерно в той же области, что и РМР. Полосы поглощения шиффовых оснований PLP еще больше сдвинуты в длинноволновую область, причем N-протонированные формы поглощают при 415—430 нм [(23—24)∙103 см-1], тогда как формы с депротонированной С=N-группой поглощают при более коротких волнах.
1) Однако сдвиг полосы поглощения на 5 нм по сравнению с полосой поглощения свободного РМР, указывает, по-видимому, на отчетливые изменения в окружении хромофора.
а. Иминные группы в свободных ферментах
Исследуя впервые высокоочищенный препарат аспартатаминотрансферазы (в 1957 г.), Дженкинс отметил удивительный факт: связанный кофермент (при рН~5) поглощал не при 390 нм, как PLP, а при 430 нм, подобно шиффову основанию (рис. 8-9). Кроме того, при повышении pH полоса поглощения сдвигалась к 363 нм. Этот результат указывает, по-видимому, на диссоциацию протона (с рКа≈6,3) с разрывом водородной связи в шиффовом основании того же типа, что и на рис. 8-5. Вскоре для этого фермента и для ряда других было показано, что (как и можно было бы ожидать для шиффова основания) восстановление боргидридом натрия приводит к переходу спектра поглощения в спектр, сходный с таковым РМР, и прочно присоединяет кофермент к белку. После полного гидролиза соляной кислотой таких восстановленных боргидридом белков была получена флуоресцирующая аминокислота, содержащая восстановленный пиридоксильный остаток; она во всех случаях была идентифицирована как ε-пиридоксиллизин:
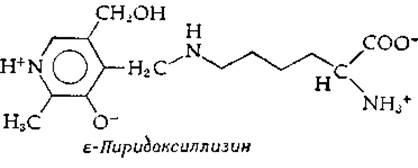
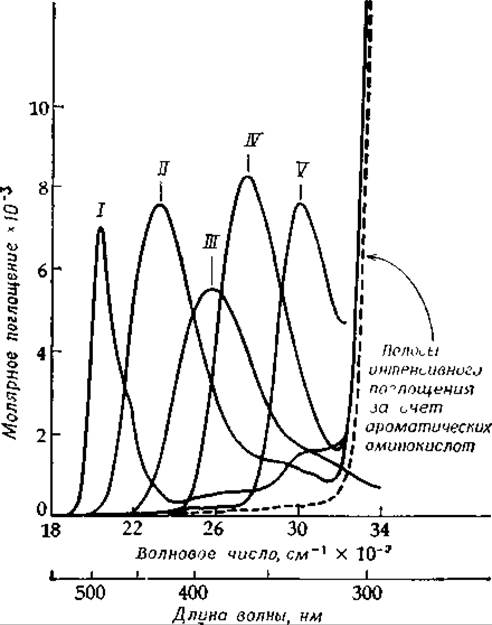
РИС. 8-9. Спектры поглощения различных форм аспартатамииотрансферазы и свободного пиридоксальфосфата. Поглощение [см. уравнение (13-5)] представлено в виде зависимости от энергии квантов света в единицах волновых чисел. Дана также более широко распространенная шкала длин волн. Чаще в приводимых спектрах длина волны возрастает слева направо. Однако форма, которой мы здесь придерживаемся, в настоящее время становится все более распространенной. Переход фермента из формы, наблюдаемой при низких значениях pH (рН<5), в форму, существующую при высоких значениях pH, контролируется группой с рКа≈6,3. Добавление эритро-ß-оксиаспартата приводит к хиноидной форме, спектр которой представлен здесь в одну треть от истинной величины. Спектр свободного PLP получен при pH 8,3. Спектр апофермеита (штриховая линия) характеризуется небольшим остаточным поглощением в области 300—400 нм, причина которого не выяснена. І— (+)эpитpo-ß-OH-Asp, 500 нм; II — 430 нм, при низком значении pH; III — 390 нм, свободный PLP, при pH 8,3; IV — 363 нм, при высоком значении pH; V — 330 им, PLP.
Таким образом, PLP-содержащие ферменты в отсутствие субстратов содержат кофермент в форме шиффова основания с ε-аминогруппой
лизинового остатка белков1). Возможно, что исключением является 6-аминолевулинат-синтетаза [уравнение (8-20)], в которой предполагается существование аддукта между PLP и —SH-группой активного центра [51].
б. Трансальдиминирование
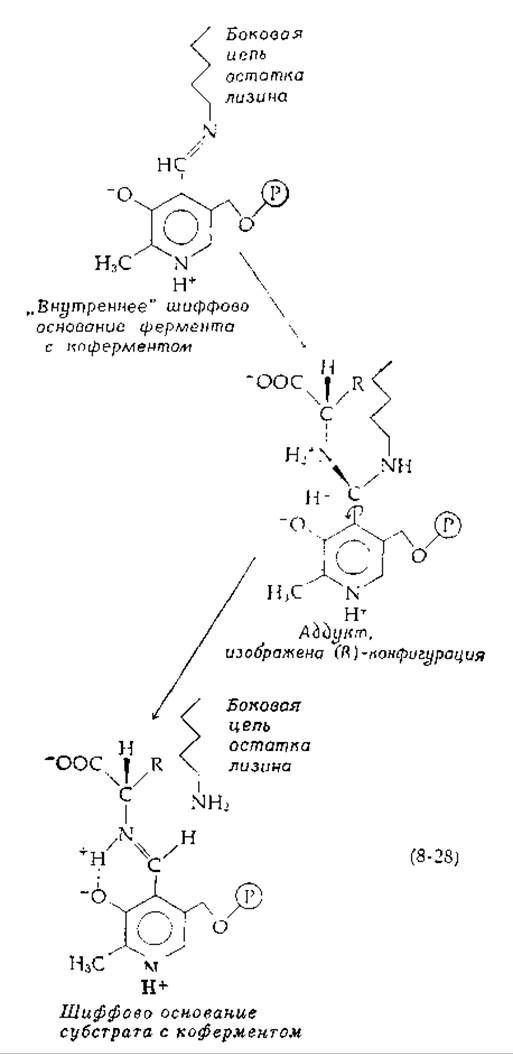
Образование шиффова основания PLP с субстратом, по-видимому, происходит путем присоединения аминогруппы не к С=О-группе, а к C=N-гpyппe. За присоединением следует элиминирование, но не группы —ОН, а ε-NН2-группы [уравнение (8-28)]:
1) Восстановление гликогеифосфорилазы боргидридом натрия приводит к прикреплению PLP к боковой цепи лизина, но фермент при этом остается удивительно активным.
Этот механизм, возможно, используется ферментом, потому что присоединение к —НС—NH+ происходит быстрее [52], чем присоединение к —НС=О. Трансальдиминирование подтверждается временным исчезновением положительного кругового дихроизма (КД) (гл. 13, разд. Б,5) в полосе поглощения кофермента при добавлении субстрата. После превращения субстрата круговой дихроизм появляется вновь1).
в. Полосы поглощения при 500 нм
Наиболее поразительны спектры поглощения, полученные в особых условиях для многих PLP-ферментов они содержат интенсивные и необычно узкие полосы в области 500 нм (20∙103 см-1). Такая полоса наблюдается у аспартатаминотрансферазы при ее действии на эритро- ß-оксиаспартат (рис. 8-9). Этот псевдосубстрат очень медленно претерпевает переаминирование, и накапливающаяся форма, которая поглощает при 500 нм, возможно, возникает как промежуточная структура и в нормальном каталитическом цикле. Аналогичный спектр поглощения обнаруживается при взаимодействии триптофаназы с конкурентным ингибитором L-аланином. В тех же условиях фермент катализирует быстрый обмен а-водорода аланина с 2Н из 2Н2О. Сериноксиметилаза дает полосу при 495—500 нм как с D-аланином, так и с нормальным продуктом реакции — глицином [53]. Принято считать, что эти полосы обусловлены предполагаемыми хиноидными промежуточными структурами.
1) Нс ясно, почему полосы поглощения PLP в ферментах практически всегда обладают положительными КД. КД, по-видимому, индуцируется в симметричном хромофоре (в поглощающей свет группе) под действием электронно-асимметричного окружения белка. [Исключение составляют описанные в следующем разделе длинноволновые полосы поглощения хиноидных форм субстрат-коферментных иминов: с ними, как правило, связан интенсивный отрицательный экстремум КД. — Прим. ред.]