Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Кетокислоты и другие необычные электрофильные центры
Уроканаза
Катаболизм гистидина в большинстве организмов начинается с элиминирования NH3 [уравнение (8-32), стадия а].
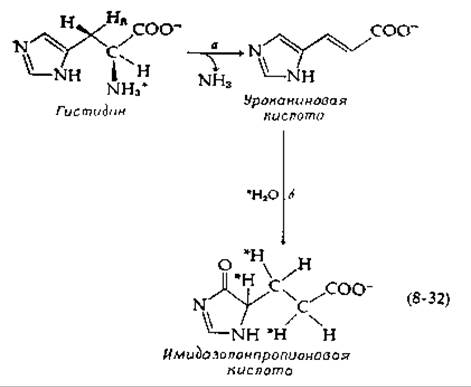
Реакция несколько необычна, поскольку элиминируемый нуклеофильный заместитель расположен при а-углеродном атоме, а не при ß-углероде [сравни уравнение (7-41); направление обратное]. На второй стадии другой необычный фермент, уроканаза, превращает уроканиновую кислоту в имидазолонпропионовую кислоту [уравнение (8-32), стадия б]. Путем восстановления уроканазы из Pseudomonas putida 3Н-содержащим NaBН4 было показано, что белок содержит N-концевой а-кетобутирильный остаток [61].
Каталитическую реакцию [уравнение (8-32), стадия б] можно представить себе как 1,4-присоединение молекулы воды к уроканиновой кислоте с последующей перегруппировкой [уравнение (8-33)].
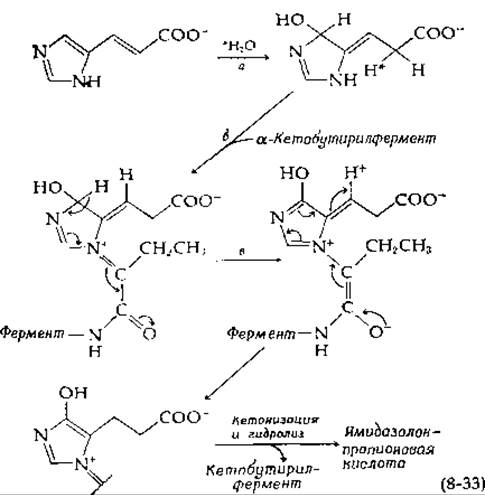
Джордж и Филлипс [61] предположили, что а-кетобутирильная группа образует положительно заряженный имин [уравнение (8-33), стадия б], который может затем перегруппироваться, как указано на схеме. Если реакция протекает в меченой Н2О, то в продукт включаются три Н-атома растворителя [62]; в уравнении (8-32) они отмечены звездочками.