Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Флавиновые коферменты
Механизм действия флавиновых дегидрогеназ
В начале разд. Ж указывалось, что все реакции гидрирования и дегидрирования можно объяснить, исходя из концентраций гипотетического гидрид-иона Н-, который действует как нуклеофил и который либо отщепляется от восстановленного кофермента, либо акцептируется окисленным коферментом. Правдоподобный механизм переноса гидрид-иона для флавопротеидных дегидрогеназ можно записать в следующей форме:
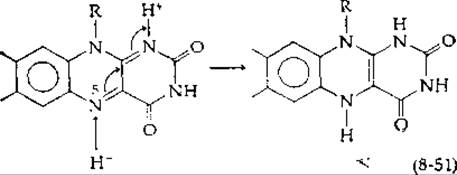
Гидрид-ион присоединяется в положение 5, а протон — в положение 1. Таким образом, можно представить окисление спиртов, аминов, кетонов и восстановленных пиридиннуклеотидов.
Хотя лишь очень немногие реакции, катализируемые флавопротеидами, успешно проведены в модельных системах, неферментативное окисление NADH флавинами происходит с умеренной скоростью в водном растворе при комнатной температуре. Исследования, проведенные с различными флавинами и производными дигидропиридина, и наблюдаемые при этих реакциях электронные эффекты согласуются с механизмом переноса гидрид-иона [114].
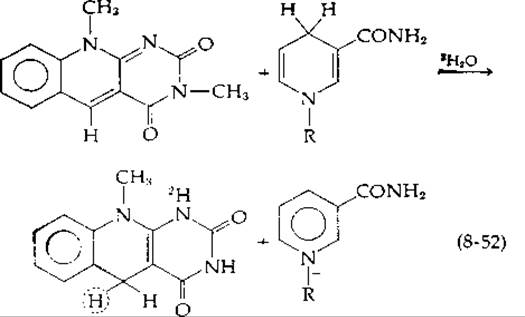
Согласно механизму, описанному уравнением (8-51), гидрид-ион мог бы переноситься непосредственно от углеродного атома в молекуле субстрата на флавин так, как это происходит при восстановлении NAD+ или NADP+ дегидрогеназами. Однако если бы меченый водород переносился в положение 5, то он немедленно обменивался бы со средой, поскольку для водородов, связанных с азотом, характерен быстрый обмен. Чтобы обойти это затруднение, Брюстлайн и Брюс использовали для неферментативного окисления NADH 5-деазафлавин [115] [уравнение (8-52)].
Если реакция проводится в среде 2Н2О, то включения 2Н в С-5 продукта не происходит. Это обстоятельство указывает на то, что атом водорода [в уравнении (8-52) обведен кружком] непосредственно переносится от NADH в положение 5. Аналогичный прямой перенос в положение С-5 5-деазарибофлавин-5'-фосфата наблюдался для флавопротеида N-метилглутаматсинтетазы [116]. (Этот фермент катализирует показанную в табл. 8-4 двухстадийную реакцию типа в, при которой глутамат реагирует с метиламином с образованием N-метилглутамата и аммиака.) Описан также прямой стереоспецифический перенос 3Н от а-3Н-аланина на деаза-FAD [116а]. Несмотря на то что эти эксперименты подтвердили прямой перенос водорода, они не доказывают наличия механизма с участием гидрид-иона.
На основании исследования реакций присоединения с участием изоаллоксазинового кольца флавинов предложен другой возможный механизм восстановления флавинов. Сульфит-ион присоединяется к положению 5 с образованием N—S-связи. Между тем Гамильтон [117] предположил, что более обычным пунктом присоединения нуклеофилов является углеродный атом 4а, который совместно с атомом N-5 образует циклическое шиффово основание. Согласно Гамильтону, другие электрофильные центры молекулы, такие, как 2-, 4- и 10а-углеродные атомы были бы нереакционноспособными вследствие их участия в резонансах амидного и амидинового типов. Спирт (или иной субстрат1)) может присоединяться к флавину следующим образом [стадия а в уравнении (8-53)].
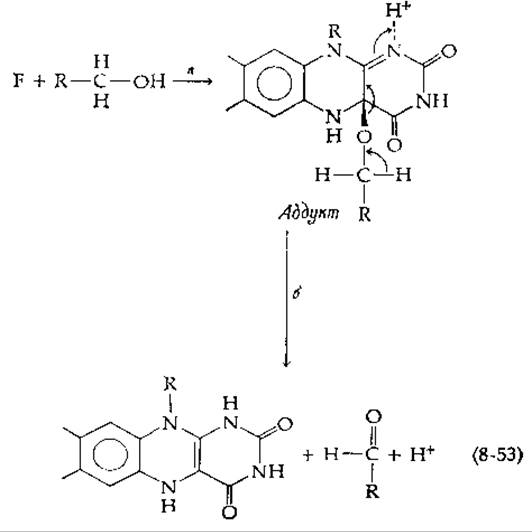
Затем может происходить расщепление вновь образовавшейся связи С—О в результате смещения электронов от спиртовой части аддукта к флавину [уравнение (8-53), стадия б]. Продуктами являются восстановленный флавин и альдегид. К тому же результату приводит перенос гидрид-иона от углеродного атома спирта, однако в этом случае водород отделяется от углерода в форме протона. Фактически оба водорода исходного субстрата (при кислороде и при углероде) диссоциируют в форме протонов, причем в процессе расщепления аддукта электроны переносятся в виде электронной пары. Гамильтон утверждал, что перенос гидрид-иона — явление редкое в биохимических процессах, и одна из причин этого заключается в том, что изолированный гидрид-ион имеет большой диаметр в отличие от протона, который сравнительно мал и обладает большой подвижностью. Исходя из этого, Гамильтон считал, что дегидрирование чаще всего осуществляется механизмами переноса протона.
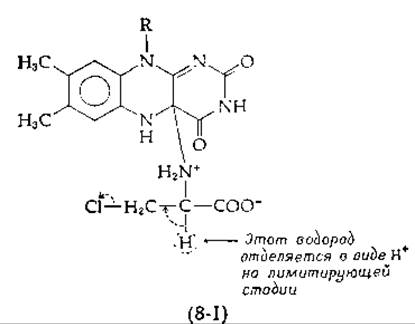
Экспериментальное подтверждение механизма протонного переноса, аналогичного механизму, показанному в уравнении (8-53), было получено при использовании D-хлораланина в качестве субстрата оксидазы D-аминокислот [118]. Продуктом этой реакции должен быть хлорпируват, однако при анаэробных условиях образуется пируват [уpавнение (8-54)]
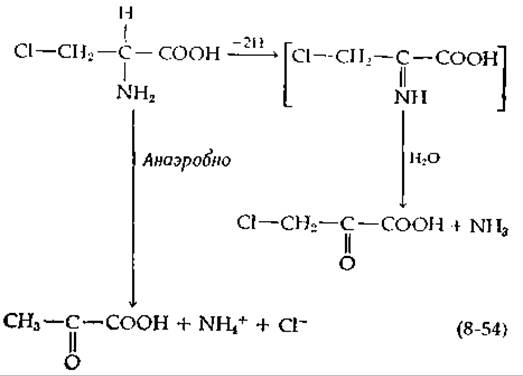
Кинетические данные, полученные с [а-2Н] - и [а-3Н] -субстратами, указывают, по-видимому, на наличие общего промежуточного соединения в обеих реакциях уравнения (8-54). Этим промежуточным соединением мог бы быть анион (8-І) образующийся в результате отщепления Н+ от аддукта, аналогичного тому, который был приведен в уравнении (8-53).
От этого аниона может отщепиться хлорид-ион, как показано на схеме штриховыми стрелками; это привело бы к образованию пирувата без восстановления флавина. В то же время электроны могли бы переноситься от карбаниона на флавин, восстанавливая его так же, как в реакции (8-53). Этот процесс происходит только в присутствии О2, указывая на то, что дело здесь обстоит значительно сложнее. Кислород должен связаться прежде, чем произойдет восстановление флавина. Но где и как он связывается, требуется установить.
1) Гамильтон предположил, что аддукты с производными ацил-СоА могут образовываться в результате взаимодействия карбонильного кислорода субстрата с 4а-углеродным атомом флавина. Читатель может при желании выписать детальные механизмы для реакций дегидрогенизации с промежуточным образованием подобных соединений
Возникает вопрос: согласуется ли прямой перенос водорода, о котором упоминалось в предыдущем разделе, с механизмами такого типа, который показан в уравнении (8-53)?
Третий возможный механизм катализируемого флавином дегидрирования состоит в последовательном переносе атома водорода и электрона с промежуточным образованием радикалов как флавина, так и окисляемого субстрата. Этот механизм полностью использует склонность флавинов к образованию стабильных радикалов, чему посвящен следующий раздел. Часто высказывалось предположение, что промежуточные радикалы, получаемые из спиртов, аминов и т.д., настолько нестабильны, что их образование термодинамически невозможно. Тем не менее Брюс и Яно [119] и другие исследователи [119а] утверждают, что механизмы с промежуточным образованием радикалов возможны.