Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Флавиновые коферменты
Полувосстановленные флавины
Одним из наиболее характерных свойств флавинов является их способность акцептировать один электрон с образованием радикала или семихинона. Если окисленную форму флавина (F) смешать с восстановленной формой (FH2), то один атом водорода переносится от FH2 к F с образованием двух радикалов FH
![]()
Равновесие, представленное этим уравнением, не зависит от pH, однако, поскольку все три формы флавина характеризуются различными величинами рКа (рис. 8-16), кажущиеся константы равновесия, объединяющие сумму концентраций окисленной, восстановленной и радикальной форм, изменяются при варьировании pH [120, 121]. Доля радикалов больше при низких и высоких значениях pH по сравнению с нейтральными значениями pH. Для 3-алкилфлавина [120] константа образования радикала Kfсоставляет 2,3∙10-2, а для рибофлавина [121]—1,5 ∙ 10-2. Зная эти величины и величины рKа, приведенные на рис. 8-16, можно оценить концентрацию радикалов при любом значении pH.
Незаряженные флавиновые радикалы имеют синюю окраску (длина волны максимума поглощения λмакс составляет ~580 нм), однако протонирование по N-1 или диссоциация протона от N-5 приводят к имеющим красную окраску катион или анион-радикалам с λмакс ≈ 470 нм. (Полный спектр см. в книге Малера и Кордеса [122].) Как синий, так и красный радикалы наблюдаются и у ферментов, причем у одних ферментов предпочтителен один радикал, а у иных — другой. Хеммерих предположил, что ферменты, образующие красные радикалы, содержат группу, образующую сильную водородную связь с протоном в положении 5. Это повышает основность N-1 и, таким образом, приводит к его протонированию и образованию красного катион-радикала.
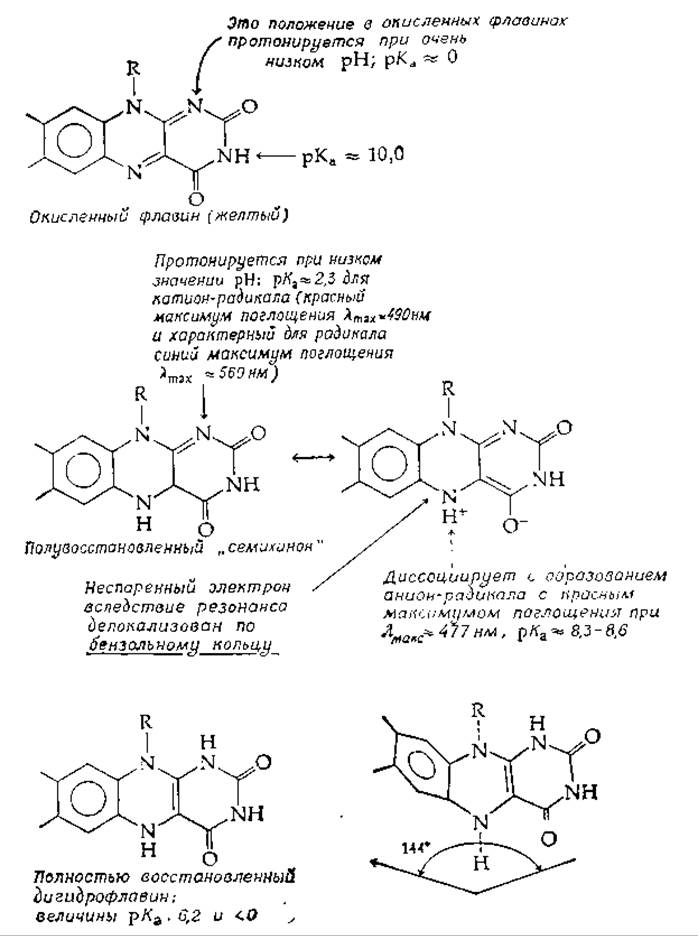
РИС. 8-16. Свойства окисленного, полувосстановленного и полностью восстановленного флавинов (см. Мюллер и др. [120]).
Если фермент связывает флавиновый радикал значительно сильнее, чем полностью окисленную или восстановленную формы, то восстановление флавопротеида протекает в две одноэлектронные стадии. В таких белках величины Е0' двух стадий могут значительно различаться. Например, существует предположение, что небольшой флаводоксин (азотофлавин) из Azolobacter, переносящий электрон, участвует в фиксации N2(гл. 14, разд. А,2). Азотофлавин образует синий семихинон и характеризуется значениями Е0' (pH 7,7), равными —0,270 и —0,464 В при pH 7,7 соответственно [123]. Последнее значение является наиболее низким из известных значений потенциалов для флавoпротеидов.
Сходные флаводоксины получены из анаэробных бактерий и на сине-зеленых водорослей (фитофлавин). Определение трехмерных структур двух флаводоксинов показало, что прочно связанный рибофлавин-5'-фосфат [124, 125] «погружен» частично вблизи поверхности полипептида, построенного из 138 аминокислот. Боковая цепь ароматической аминокислоты — триптофана или тирозина — прилегает к флавину на поверхности молекулы белка. Удивительным было обнаружение у флаводоксина клостридий связи фосфатной группы кофермента не с катионными боковыми группами аргинина или лизина, а с кластером нейтральных полярных групп, включающим четыре гидроксильные группы остатков серина и треонина и четыре NH-группы полипептидной цепи [124]. Можно получить кристаллы всех трех форм флаводоксинов: окисленного, полностью восстановленного и семихинона. Флавиновый семихинон, так же как и окисленный флавин, в кристалле находится в практически плоской конформации. У всех флаводоксинов две ступени восстановления хорошо разделены. Например, флаводоксин из Peptococcus elsdenii характеризуется значениями Е0', равными —0,115 и —0,373 В при pH 7.