Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Гемопротеиды
Цитохромы
Изменения в спектре поглощения клеток, которые наблюдал Кейлин, являются результатом окисления двухвалентного железа цитохромов в трехвалентное. Таким образом, эти белки выполняют функцию одноэлектронных переносчиков, активным центром которых является группа гема. Описано множество цитохромов, выделенных из различных источников [12—14]. Введенная Кейлином классификация, согласно которой среди цитохромов выделяют группы а, b и с, основана на положении в спектре поглощения a-полосы (полосы с наибольшей длиной волны, рис. 10-2). Однако в настоящее время для обозначения новых цитохромов принято указывать значение длины волны а-полосы, например цитохром 552 или цитохром b-557,5. Что касается обозначений a, b, с и d, то их сейчас принято связывать с типом гема (рис. 10-1).
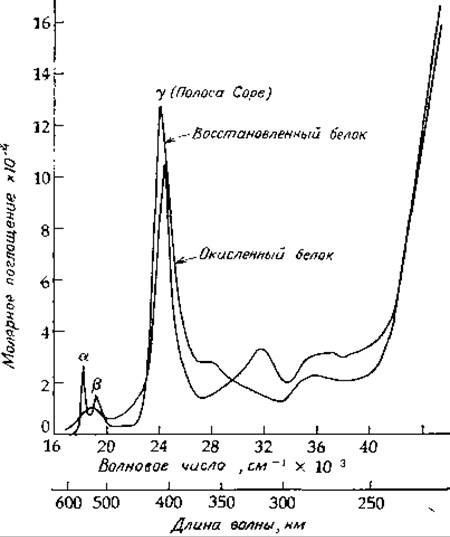
РИС. 10-2. Спектры поглощения окисленного и восстановленного цитохрома с из сердечной мышцы лошади при pH 6,8. По данным Margoliash Е., Frohwirt N., BJ, 71, 570—572 (1959).
Цитохромы b-типа содержат протогем, который также обнаружен в бактериальных цитохромах о [13—16]. Типичные цитохромы b не реагируют с О2, однако цитохром о служит конечным акцептором электронов (цитохромоксидазой) и способен к автоокислению молекулярным кислородом. Другой протогемсодержащий цитохром, участвующий в гидроксилировании, называется цитохромом Р-450. В этом случае цифра 450 указывает положение интенсивной «полосы Соре» (называемой также y-полосой, рис. 10-2). Для обозначения цитохрамов используют и другие свойства. Например, цитохром аз по спектру поглощения сходен с цитохромом а, но в отличие от него легко реагирует как с СО, так и с О2.
Цитохром с является одним из немногих внутриклеточных гемовых пигментов, растворимых в воде и легко удаляемых из мембраны. Митохондриальный цитохром с был одним из первых цитохромов, который удалось получить в очищенном виде и закристаллизовать. Структура этого белка как в ферри-, так и в ферроформе была определена методом рентгеноструктурного анализа. Цитохром с — небольшой белок с мол. весом ∼13 000, содержащий 104 аминокислотных остатка; он был выделен из растений, животных и микроорганизмов-эукариотов [12, 17,18]. Полная аминокислотная последовательность этого белка была определена более чем для 50 видов. 28 положений в пептидной цепи оказались инвариантными. Ряд других положений характеризуется только «консервативными» заменами. Цитохром с явился одним из белков, в отношении которых предпринимались попытки проследить по наблюдаемым изменениям в последовательности эволюционные взаимоотношения между видами. Например, человек и шимпанзе имеют совершенно одинаковый цитохром с, однако между цитохромом с человека и лошади имеется уже 12 различий в аминокислотной последовательности, а цитохром с нейроспоры имеет 44 отличия от цитохрома с человека [17]. В клетках фотосинтезирующих бактерий Rhodospirillum rubrum содержится родственный цитохром с2, который, как полагают, дивергировал от предшественника цитохрома с млекопитающих 2∙109 лет назад. Но даже и в этом случае 15 положений в цепи остаются инвариантными, а в других положениях имеются функционально эквивалентные остатки [19].
Структурные исследования цитохрома с и цитохрома с2 показывают [12, 17—19], что группа гема служит каркасом, на который наматывается пептидная цепь. 104-х остатков цитохрома с как раз хватает на образование оболочки вокруг гема. Как в окисленной, так и в восстановленной формах белка пятое и шестое координационные положения железа занимают метионин-80 (рис. 10-3, слева) и гистидин-18 (рис. 10-3, справа). В результате гем оказывается плотно закрытым полипептидной цепью и почти недоступным для растворителя. В связи с этим обстоятельством возникает целый ряд вопросов.
Каким образом электрон поступает в феррицитохром с и восстанавливает его и как электрон покидает экранированную группу гема ферроцитохрома с, восстанавливая цитохромоксидазу? Одной из возможностей является переход на железо (Fe3+) электрона атома серы (метионина-80), при этом происходит образование радикала с дефицитом электронов. Как нетрудно себе представить, образовавшаяся «дырка» могла бы заполниться электроном, поступающим от —ОН-группы соседнего тирозина-67. Этот тирозин мог бы далее сместиться на поверхность и, вступив в контакт с тирозином-74, принять от него электрон [17]. Таким образом, редуктаза, действующая на феррицитохром с, должна взаимодействовать с расположенным на поверхности тирозином-74. Хотя подобный механизм, основанный на промежуточном образовании подвижных тирозиновых радикалов, не имеет прецедента, указанная возможность заслуживает внимания. Сходное предположение [20, 21] заключается в том, что электроны поодиночке или парами поступают с поверхности через систему водородных связей на тирозин-67 и далее на метионин-80. Предлагался также вариант обмена электронов через пасть гема, выходящую на поверхность [22]. Что касается окисления цитохрома с, то Дикерсон предлагает гипотезу, согласно которой определенная группировка цитохромоксидазы (следующего фермента в цепи переноса электронов) входит в щель, имеющуюся в ферроцитохроме с, и принимает электрон.
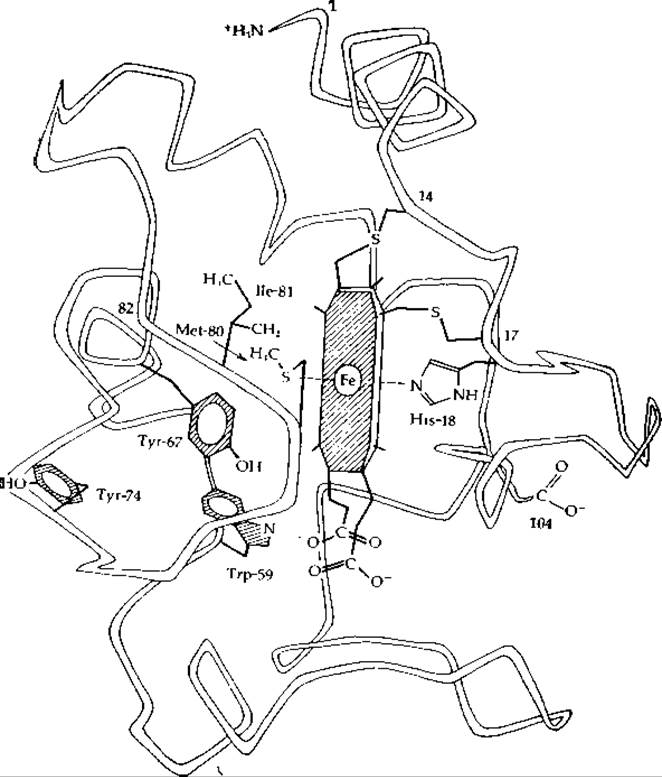
РИС. 10-3. Пептидный остов, гем с и некоторые боковые цепи цитохрома с. Из работы Дикерсона [12].
Определена также структура солюбилизированного цитохрома b5 из микросом печени. Хотя точная функция его неизвестна, можно думать, что он играет роль, подобную роли цитохрома с, взаимодействуя с ферментативной системой эндоплазматического ретикулума, катализирующей образование ненасыщенных жирных кислот. Белок содержит 93 аминокислотных остатка, а еще 44 (преимущественно гидрофобных) отщепляются с N-конца в процессе солюбилизации белка. Вероятно эта N-концевая часть служит гидрофобным якорем, погружаемым в мембрану эндоплазматического ретикулума. Гем в цитохроме b5 не связан ковалентно с белком, но прочно удерживается между двумя боковыми цепями гистидинов. По способу свертывания цепи этот белок совершенно не похож ни на цитохром с, ни на миоглобин. И в этом случае не видно путей переноса электрона от атома железа на поверхность молекулы [23].
Структура других цитохромов, функционирующих в цепи переноса электронов, пока неизвестна. Цитохром c1 (а-полоса восстановленного соединения находится при 554 нм, а в цитохроме с — при 550 нм) содержит гем, связанный с белком почти так же, как и в цитохроме с, но белок, по-видимому, имеет более высокий молекулярный вес. Известно несколько форм цитохрома b (табл. 10-5); его молекулярный вес выше, чем у цитохрома с; возможно образование прочного комплекса цитохрома b с убихиноном [24].
Цитохромоксидазы выполняют в аэробных организмах уникальную функцию: они соединяются с O2 почти таким же образом, как и гемоглобин, а затем быстро восстанавливают O2 до двух молекул Н2O [24а]. Происходит разрыв связи О—О; для восстановления требуется четыре электрона. Очевидно, процесс этот сложен и пока еще плохо изучен. Важно отметить, что цитохромоксидаза, содержащаяся в митохондриях млекопитающих, имеет два гема (цитохром а) и два атома Cu(I) на одну функциональную единицу. Таким образом, при восстановлении обеих молекул цитохрома а и двух атомов меди может быть запасено четыре электрона для последующего восстановления одной молекулы O2. Химия цитохромоксидазы слабо изучена. Как впервые обнаружил Кейлин, только половина молекул цитохрома а соединяется с СО. Она была названа цитохромом а3. По данным электрофореза в полиакриламидном геле с додецилсульфатом натрия, в цитохромоксидазе дрожжей имеется шесть или семь субъединиц с мол. весом от 5 000 до 42 000 [24b, с]. Интересно отметить, что три наиболее крупные субъединицы, по-видимому, кодируются генами митохондриальной ДНК. Группы гема присоединены к пептидам меньшего размера. Было высказано предположение, что в интактном ферменте молекула O2 вначале связывается между атомом железа цитохрома а3 и ионом двухвалентной меди: а2+3—O2—Сu+. На следующей стадии происходит двухэлектронный процесс восстановления O2 с образованием перекисной структуры и далее двух молекул воды.
В разд. Е,1 и Е,2 рассматриваются еще некоторые другие цитохромы. Опубликованы подробные обзоры по бактериальным цитохромам [13, 15] и работы с более широким обсуждением свойств цитохромов [12, 24].