Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Гемопротеиды
Каталаза и пероксидазы
Другая группа гемовых ферментов катализирует реакции, в которых участвует не O2, а перекись водорода Н2O2. Пероксидазы широко распространены в растительных тканях, где они находятся преимущественно в пероксисомах; в небольшом количестве они имеются и в животных тканях. Они катализируют следующую реакцию:
Н2O2 + АН2 → 2Н2O + А. (10-4)
Каталаза является ферментом, неизменно присутствующим в аэробных клетках; иногда ее количество может достигать 1 % от сухого веса бактерий. Этот фермент катализирует распад Н2O2 на воду и кислород. Постулируемый механизм в основных чертах совпадает с механизмом действия пероксидаз. Если в уравнение (10-4) вместо АН2 подставить Н2O2, а вместо А — O2, то получим
![]()
Каталаза функционирует очень быстро, почти в 104 раз быстрее пероксидаз. Молекулярная активность (на каталитический центр) составляет примерно 2∙105 с-1.
Каталаза, согласно существующим представлениям, выполняет защитные функции, препятствуя накоплению H2O2, оказывающей повреждающее действие на клеточные компоненты. Гибельное действие О2 на облигатные анаэробы, возможно, объясняется отсутствием у них этого фермента. В пользу такого представления говорит существование наследственной болезни акаталаземии [25]. Люди с очень низкой активностью каталазы встречаются во многих местах, но особенно их много в Корее. По имеющимся оценкам, в Японии насчитывается 1800 человек, лишенных каталазы. Поскольку примерно у половины этих людей не наблюдается никаких симптомов, каталазу можно было бы отнести к несущественным ферментам. Однако у многих лиц вокруг зубов развиваются язвенные процессы, которые могут приводить к серьезным осложнениям. По-видимому, перекись водорода, вырабатываемая бактериями, по мере накопления окисляет гемоглобин в метгемоглобин (дополнение 10-А), лишая пораженные ткани кислорода.
Наиболее широко исследована пероксидаза, выделяемая из хрена и содержащая один гем на молекулу белка с мол. весом 40 000. Каталазы обычно представляют собой тетрамеры с мол. весом 250 000. Как пероксидазы, так и каталаза содержат высокоспиновое железо Fe (III) и по свойствам напоминают метмиоглобин. Ферменты могут быть восстановлены до Fe(II)-состояния, в котором они могут присоединять (необратимо) О2. Мы видим, что тот же активный центр, который имеется в гемоглобине, присутствует также в пероксидазах и каталазе, но на химию этого активного центра сильное влияние оказывает белок. Очень сильно меняется сродство к О2, а у ферригемсодержащих белков возникают новые виды каталитической активности.
Механизм действия каталаз и пероксидаз еще во многом неясен, однако особенно большое внимание привлекло образование в присутствии субстратов целого ряда промежуточных форм, поразительно отличающихся по окраске [25а]. Когда к раствору пероксидазы добавляют небольшой избыток Н2O2, темно-коричневый фермент сначала становится оливково-зеленым (соединение I), а затем по мере образования соединения II — бледно-алым. Соединение II медленно реагирует с субстратом АН2 (или с другой молекулой Н2О2) с регенерацией исходной формы фермента. В уравнении (10-6) эта последовательность реакций представлена верхней горизонтальной линией стрелок:
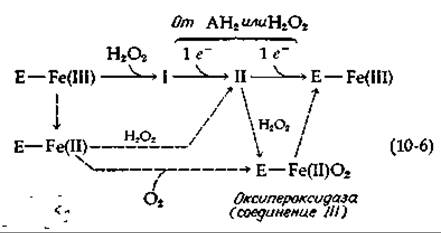
Титрование показывает, что соединение I превращается в соединение II одноэлектронным восстановлением, а соединение II превращается в свободную пероксидазу другим одноэлектронным восстановлением (например, с использованием ферроцианида). Таким образом, железо в соединении I может быть формально представлено как Fe(V), а в соединении II — как Fe(IV). Однако это мало что нам говорит о судьбе Н2О2 в реакции с ферментом, когда образуются соединения I и II. Присутствуют ли атомы кислорода Н2О2 в соединениях I и II или нет? По этому поводу развернулись горячие дебаты, но окончательный ответ так и не получен. Рассмотрим, однако, следующие данные. Фермент в Fe(III)-форме, как уже упоминалось ранее, может быть восстановлен в форму Fe(II). Когда Fe(II)-фермент реагирует с Н2O2, он, вероятно, превращается в соединение II, из чего можно заключить, что последнее представляет собой Fe(II)-комплекс с перекисным анионом [26—28]:
Е—Fe+(II)—ООН
Ясно, что в этом комплексе железо находится в низкоспиновом состоянии. Тем не менее исследователи предпочитают рассматривать соединение II как комплекс феррильного железа, который может образоваться из предыдущей структуры присоединением протона и удалением воды:
Е—Fe2+(IV) О.
Присоединение Н2О2, по-видимому, превращает соединение II в соединение III, которое, согласно существующим представлениям, идентично оксипероксидазе. Последняя образуется в результате присоединения O2 к ферроформе свободного фермента [уравнение (10-6)] Н2O2, участвующая в превращении соединения II в оксипероксидазу, по-видимому, восстанавливается, образуя две молекулы воды.
Если неясна структура соединения II, то это еще в большей степени относится к соединению I. Первоначально считали, что оно представляет собой комплекс Fe(III) с Н2O2 или ее анионом. Однако подобная структура плохо согласуется с наблюдаемыми магнитными и спектральными свойствами. Было много рассуждений по поводу локализации атомов кислорода, входящих в состав связанной перекиси водорода. Мы познакомим читателя с некоторыми деталями, которые следует учитывать в ходе размышлений над этой проблемой. В уравнении (10-5) Н2O2 можно заменить на ROOH — органическую перекись; превращение формы І в II и дальнейшее превращение в свободный фермент могут быть осуществлены с помощью одноэлектронного донора, в частности с помощью К2IrВr6. Если донором электрона служит субстрат АН2, то продуктом превращения соединения I в соединение II будет свободный радикал АН2. Этот свободный радикал может отдать еще один электрон, требуемый для образования свободного фермента; может быть использована вторая молекула АН2, тогда образуются два радикала АН. Последние могут превратиться в А и АН2.
Хлорпероксидаза [29], выделяемая из плесневого гриба Caldariomyces fumago, осуществляет реакцию хлорирования органических соединений, используя Н2O2 и Сl- [уравнение (10-7)].
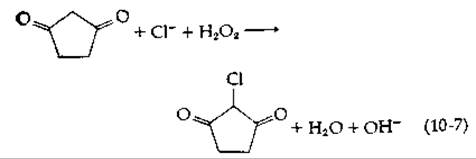
Присоединение хлора сопровождается кратковременным образованием переходного соединения железа, спектрально неотличимого от соединения I. Для него была предложена структура Fe—ОСl [29]. Белок имеет молекулярный вес ~ 42 000; он был выделен в низкоспиновом феррисостоянии. Восстановленный феррофермент является высокоспиновой формой; спектроскопически он почти идентичен цитохрому Р-450 (разд. Ж,2, е) [29, 30]. Лактопероксидаза молока в присутствии I- и Н2O2 катализирует совершенно аналогичную реакцию иодирования в белках остатков тирозина и гистидина. Широко используется метод введения изотопов 125I- и 131I- в белки на экспонированных поверхностях мембран [31].
Миелопероксидаза полиморфноядерных лейкоцитов (гл. 1, разд. Д,2, б) использует Н2О2 н ион галоида для атаки фагоцитированных бактерий [32, 33]. Фагоцитоз индуцирует усиление дыхания лейкоцитов и выработку Н2О2, частично осуществляемую мембраносвязанной NADPH-оксидазой. Некоторая часть Н2О2 используется миелопероксидазой для атаки бактерий; по-видимому, это происходит в результате образования НОСl [33а]. Могут быть использованы и другие кислородзависимые механизмы поражения бактерий [34]. Наследственный недостаток NADH-оксидазы (признак, сцепленный с Х-хромосомой) может приводить к развитию опасной болезни — грануломатоза, при котором исчезает сопротивляемость организма к заражению многими обычными бактериями.