Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Использование энергии неорганических реакций
Восстановленные неорганические соединения как субстраты дыхания
а. Бактерии, окисляющие водород
Отдельные виды бактерий, принадлежащих родам Hydrogemonas, Pseudomonas и Alcaligenes, могут окислять Н2 кислородом:
![]()
Некоторые бактерии могут окислять окись углерода:
![]()
Водородные бактерии могут окислять и органические соединения. Метаболизм у них носит довольно упрощенный характер. Электроны проходят по цепи переносчиков, генерируя три молекулы АТР. Ключевым ферментом служит связанная с мембраной гидрогеназа, поставляющая электроны для цепи переносчиков. Отдельная растворимая гидрогеназа (иногда называемая водород-дегидрогеназой) передает электроны NADP+ с образованием NADPH, который далее используется в восстановительном пентозофосфатном цикле и в других процессах биосинтеза [110].
Вероятно, здесь уместно прокомментировать широкое распространение самых различных гидрогеназ [111]. Эти ферменты встречаются во многих организмах, в том числе у некоторых растений и животных (гл. 9, разд. Е,2); они часто служат для освобождения из клеток «избытка» водорода (гл. 9, разд. Е,2). В этом случае функция гидрогеназ оказывается противоположной их функции у бактерий, окисляющих водород. Некоторые гидрогеназы встроены в мембрану и через группу неидентифицированных переносчиков связаны с формиатдегидрогеназой (гл. 9, разд. В,3). В строго анаэробных организмах, таких, как клостридии, гидрогеназы связаны с ферредоксинами. Очищенные гидрогеназы оказались железо-серными белками [50, 111, 112]. Фермент из Clostridium pasteurianum имеет мол. вес 60 000 и содержит четыре атома железа и четыре атома лабильной серы. Высказывалось предположение, что гидрогеназа содержит кластер Fe4S4, способный принимать или отдавать один или два электрона, и что этот кластер является центром связывания или образования Н2 [111].
б. Нитрифицирующие бактерии
Два рода почвенных бактерий превращают ионы аммония в нитрит и нитрат [уравнения (10-24) и (10-25)]1) [113]:
Эти изменении свободной энергии можно оценить по данным табл. 3-3. Используя первую колонку (∆G0f), рассчитывают, что ∆G'0для уравнения (10-24) составляет —34,5—237,2+79,5. Чтобы получить ∆G’ (pH 7), нужно вычесть величину 2∙7Х5,708 кДж, соответствующую разбавлению водородных ионов от активности, равной единице, до концентрации 10-7 М. Можно использовать также значение ∆G'oкисл (pH 7) окисления с помощью NAD+. В этом случае ∆G' (pH 7) для уравнения (10-24) оценивается как 12,3+372,7—219,0∙3 кДж. Третий член представляет собой свободную энергию окисления трех молей NADH за счет ![]()
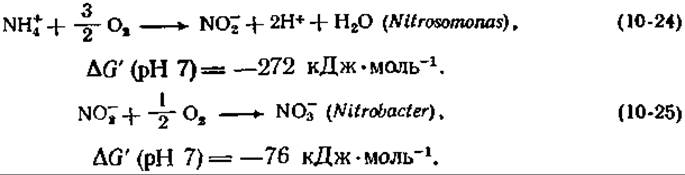
Важное значение этих реакций для энергетического обмена бактерий было установлено в 1895 г. Виноградским, впервые предложившим понятие хемоавтотрофии. Поскольку нитрифицирующие бактерии растут медленно (время одной генерации составляет ~10—12 ч), было трудно набрать достаточное количество клеток для биохимических исследований, и успехи в их изучении не слишком велики. Наиболее сложно выглядит цепь реакций, катализируемых бактериями Nitrosomonas [уравнение (10-26)], которая предположительно протекает в три стадии:
Присутствие гидразина блокирует окисление гидроксиламина (NH2OH) и приводит к накоплению этого промежуточного соединения [уравнение (10-26)]. Окисление иона аммония молекулой О2 в гидроксиламин является эндергоническим процессом с ∆G' (pH 7) = = 16 кДж∙моль-1 и не может обеспечивать клетку энергией. С другой стороны, окисление гидроксиламина в нитрат за счет O2 является высоко экзергонической реакцией с ∆G' (pH 7) =—228 кДж∙моль-1. Соответствующие электродные потенциалы для двух- и четырехэлектронных стадий окисления указаны в уравнении (10-26). Как можно видеть, на второй стадии в цепь переноса электронов поставляются четыре электрона примерно с потенциалом флавопротеида. На каждые два электрона должны синтезироваться две молекулы АТР, так что полная реакция даст четыре молекулы АТР.
Попытки приготовить растворимую NH+4-окисляющую систему к успеху не привели, но зато были получены гидроксиламинокисляющие частицы, содержащие цитохромы типа b и с, а возможно, и флавины [114, 115]. По-видимому, эти частицы отщеплялись от концевой оксидазной системы (цитохрома а).
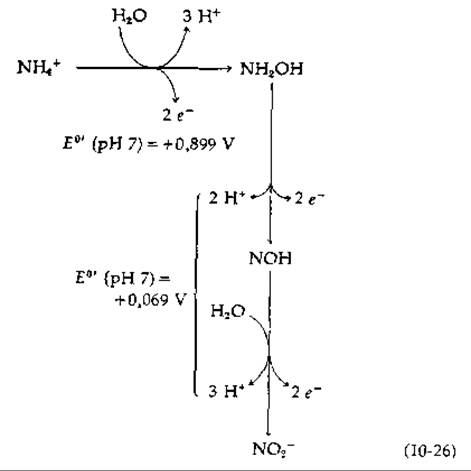
Другой род нитрифицирующих бактерий Nitrobacter получает энергию с помощью более простой реакции (уравнение (10-25)] со сравнительно небольшим понижением свободной энергии. Двухэлектронное окисление передает электроны в цепь переноса при значении Е0' = 0,42 В. Логично предположить, что на каждую пару электронов должна образовываться одна молекула АТР. Однако в мембранах Nitrobacter имеется непонятная система различных цитохромов [116, 117]. Ясно только то, что часть АТР, образующегося при переносе электронов от нитрита к кислороду, используется для запуска обращенного потока электронов, генерирующего восстановленные пиридиннуклеотиды, необходимые для реакций биосинтеза [уравнение (10-27)].
Интересная особенность строения Nitrobacter — это наличие нескольких двухслойных мембран, полностью окружающих внутреннюю часть клетки. Поступающий в клетку нитрит окисляется на этих мембранах, но не может проникнуть внутрь клетки, где он мог бы оказать токсическое действие.
в. Бактерии, окисляющие серу
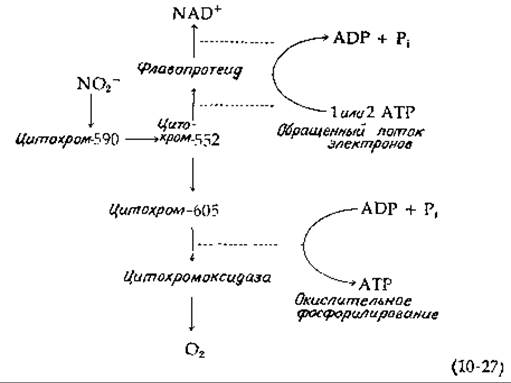
Бактерии рода Thiobacillus способны окислять сульфид, элементарную серу, тиосульфат и сульфит в сульфат [12, 118—120]. Многие из. этих маленьких грамотрицательных организмов, встречающихся в воде и в почве, могут расти на простой солевой среде, содержащей окисляемые серные соединения и СO2. Несколько усложняет понимание реакций, с помощью которых вырабатывается энергия, тенденция атомов серы к образованию цепных молекул. Так, при окислении сульфида не вполне ясно, должен ли он обязательно превращаться в элементарную серу, как показано в уравнении (10-28) (стадия а, внизу слева).
Он мог бы окисляться в сульфид, проходя через стадию образования какого-либо органического производного. Однако нередко наблюдается осаждение элементарной серы (S08)1). Тиосульфат легко окисляется всеми видами; основной путь его метаболизма начинается с расщепления на S0и SO2-3[уравнение (10-28), стадия б]. При высоких концентрациях тиосульфата какая-то его часть может окисляться в тетратионат [уравнение (10-28), стадия в].
1) Сера часто осаждается в виде маленьких шариков внутри клеток сульфидокисляющих бактерий Beggiatoa.
Хотя детали процесса неизвестны, на начальной стадии окисления элементарной серы [уравнение (10-28), стадия г] может принимать участие глутатион:
![]()
Окисление этого линейного полисульфида может протекать путем отщепления атомов серы по одному с образованием сульфида или отщеплением сразу по два атома с образованием тиосульфата [118, 119].
Окисление сульфита в сульфат осуществляется сульфит-цитохром-с — редуктазой [сульфитоксидазой; уравнение (10-28), стадия д] или идет через образование аденилилсульфата (называемого также аденозин-5'-фосфосульфатом, сокращенно APS).
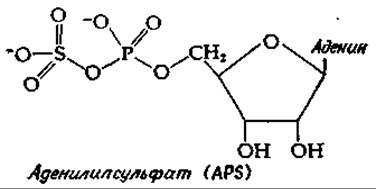
Окисление сульфида через аденилилсульфат [уравнение (10-28), стадии е и ж] интересно в том отношении, что оно обеспечивает возможность субстратного фосфорилирования — единственный пример, известный для хемолитотрофных бактерий. Однако независимо от того, какой из двух путей окисления сульфита используется, серные бактерии получают энергию в результате переноса электронов. При значении Е0' (pH 7) = —0,454 В [E0' (pH 2) =—0,158 В]|, характерном для сульфат-сульфитной пары, за счет переноса электронов может быть получено достаточно много энергии. Заметим, что окисление сульфита в сульфат сопровождается образованием ионов водорода. Действительно, для роста бактерий Thiobacillus thiooxidans оптимум pH равен 2 и бактерии могут выдерживать 5%-ную серную кислоту [119].
«Железобактерии» Thiobacillus ferrooxidans получают энергию путем окисления ферро-ионов в ферри-ионы с последующим осаждением гидроокиси трехвалентного железа [уравнение (10-30)].
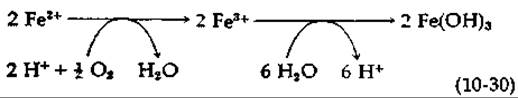
Поскольку восстановительный потенциал пары Fe(II)/Fe(III) при pH 7 равен +0,77 В, энергия, получаемая в результате этой реакции, невелика. Показательно, что эти бактерии всегда окисляют также и восстановленные серные соединения. Особенно интересно окисление ими минерала пирита, ферросульфида [уравнение (10-31) ]1):
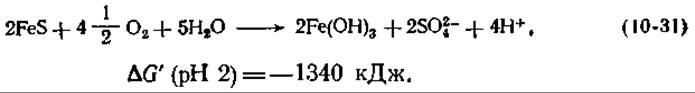
Поскольку в этой реакции образуется серная кислота, бактерии, населявшие покинутые шахты, создавали серьезную проблему в связи с загрязнением воды: вода, вытекавшая из этих шахт, часто имела pH 2,3 и даже меньше [121].
Бактерии не единственные организмы, способные окислять восстановленные соединения серы. Например, в печени животных присутствует содержащая молибден сульфитоксидаза (гл. 14, разд. Ж), функция которой, вероятно, состоит в детоксикации двуокиси серы путем окисления сульфита в сульфат [122].