Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Оксигеназы и гидроксилазы
Диоксигеназы
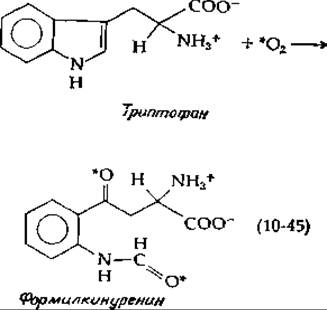
Среди оксигеназ, включающих в продукт оба атома О2, наиболее известны ферменты, разрывающие двойные связи ароматических соединений в положениях, соседствующих с ОН-группами или между ОН-группами, как показано в уравнении (10-43). Другие диоксигеназы расщепляют алифатические соединения. Хорошо известным примером является расщепление ß-каротина с образованием витамина А (дополнение 12-В). Несколько диоксигеназ было выделено в кристаллическом виде из бактерий. Они оказались белками, содержащими негемовое железо; мол. вес одной субъединицы составлял 50000 или более. Эти белки обычно содержат Fe(II), но у них нет лабильной серы [1]. С другой стороны, триптофандиоксигеназа (триптофанпнрролаза; гл. 14, разд. И) является гемовым ферментом. Она катализирует реакцию, описываемую уравнением (10-45). Атомы кислорода, помеченные звездочкой, поступают из О2.
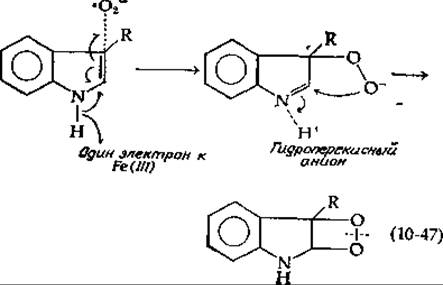
Подобно негемовым оксигеназам, триптофандиоксигеназа активна, когда входящее в ее молекулу железо находится в ферроформе. Естественно было бы предположить, что существенной первой стадией реакции служит образование комплекса между Fe(II) и О2. Однако триптофан должен присутствовать в системе еще до образования комплекса с O2. При 5°С фермент, триптофан и O2 образуют комплекс с измененным спектром, напоминающим спектр соединения III в случай пероксидаз [уравнение (10-6)]. Этот оксигенированный комплекс, возможно, далее превращается в Fe (III)-комплекс с перекисным ионом [уравнение (10-46)]. Имеются данные (базирующиеся на ингибирую?
щем действии супероксиддисмутазы, которое она оказывает на ферменты из некоторых организмов [137]), что именно перекисный анион-радикал атакует субстрат, инициируя гидроксилазную реакцию [уравнение (10-47)]. Отметим, что на первой стадии один электрон возвращается к Fе(III)-форме фермента, регенерируя исходную Fе(II)-форму.
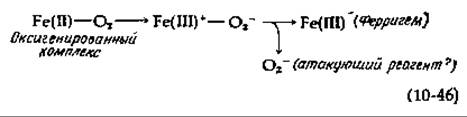
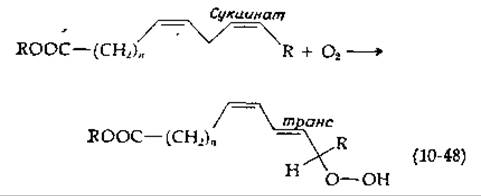
Существует растительный фермент, причисляемый к диоксигеназам, который называют липоксигеназой (липоксидазой). Не имея в своем составе ни металла, ни другой известной простетической группы, лип-оксигеназа катализирует окисление полиеновых жирных кислот в липидах [уравнение (10-48)] [138]. Образование гидроперекисного продукта сопровождается смещением двойной связи и переходом ее из цис- в транс-конфигурацию. Фермент, по-видимому, генерирует свободные радикалы, но механизм их образования неясен. Образуя в качестве продукта гидроперекись, липоксигеназа имеет определенное сходство с монооксигеназами, рассматриваемыми в следующем подразделе.