Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Оксигеназы и гидроксилазы
Монооксигеназы
Известно два класса монооксигеназ. Ферменты, требующие присутствия косубстрата [ВН2 в уравнении (10-44)] помимо гидроксилируемого субстрата, называются внешними монооксигеназами. Другую группу составляют внутренние монооксигеназы, в которых в качестве косубстрата выступает часть структуры гидроксилируемого субстрата. Многие внутренние монооксигеназы содержат флавиновые кофакторы и лишены металлов.
а. Флавинсодержащие монооксигеназы
Прежде всего вспомним, что дигидрофлавин реагирует с О2, образуя Н2О2 (гл. 8, разд. И,7). Исходя из этого факта, можно было бы думать, что монооксигеназы катализируют дегидрирование субстратов с помощью флавиновых кофакторов и что восстановленные флавины реагируют с О2, образуя Н2О2. Образовавшаяся перекись водорода используется затем в качестве гидроксилирующего агента. Соответствующий пример уже был описан в гл. 8. Лактатоксигеназа может путем дегидрирования превращать лактат в пируват и затем с помощью Н2О2 окислительно декарбоксилировать пируват в ацетат [уравнение (8-67)1. Один атом кислорода переходит из О2 в образующийся ацетат [139].
Другой внутренней монооксигеназой является лизиноксигеназа, тетрамерный FAD-содержащий белок, состоящий из субъединиц с мол. весом ~61000 [140]. Монооксигеназы сходного типа, продуцируемые бактериями, атакуют аргинин и другие основные аминокислоты. Опять-таки, судя по образующимся продуктам [уравнение (10-49)], и здесь за отщеплением водородов следует окислительное декарбоксилирование под действием Н2О2, как и в уравнении (8-67).
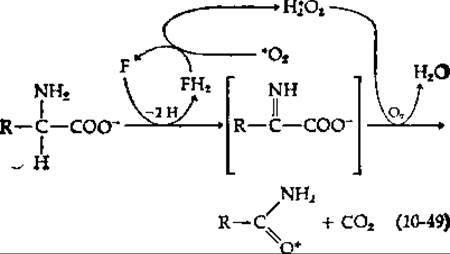
После обработки нативной лизинмонооксигеназы различными реагентами, блокирующими сульфгидрильные группы, модифицированный фермент дает в качестве продуктов а-кетокислоту, аммиак и Н2О2. Это именно те продукты, образование которых можно было бы предсказать заранее, считая, что гидролитически разрушается промежуточное соединение, стоящее в скобках в уравнении (10-49).
Один из путей, благодаря которому NADPH может использоваться в качестве косубстрата, — это восстановление флавопротеидного фермента. Восстановленный флавин может далее реагировать с О2, образуя гидроксилирующий реагент. Примером служит 4-оксибензоат — гидроксилаза — фермент, образующий в качестве продукта 3,4-диоксибензоат. NADH реагирует лишь после того, как флавопротеид образует комплекс с субстратом, — имеются данные о том, что при этом образуется оксигенированное промежуточное соединение, возможно гидроперекись, как указано в уравнении (10-50) (см. также гл. 8, разд. И,7) [141].
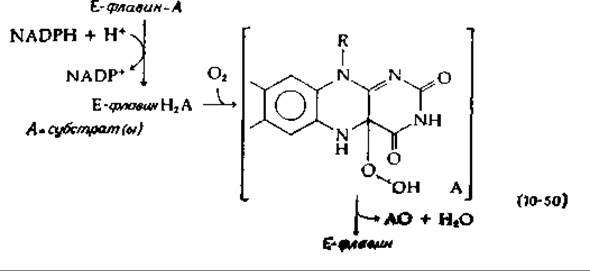
Согласно этому механизму, один из двух атомов кислорода гидроперекиси реагирует с ароматическим субстратом столь же эффективно, как и ОН+ или перекисный радикал. Другое предположение [142] состоит в том, что из гидроперекиси, фигурирующей в уравнении (10-50), может элиминироваться Н2О с образованием оксазиридина, способного выступать в качестве активного гидроксилирующего реагента [уравнение (10-51)].
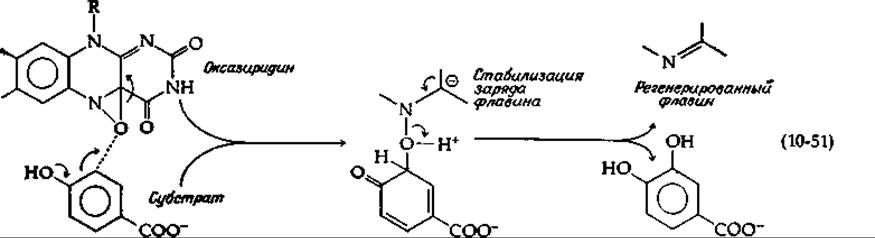
Атака оксазиридином нуклеофильного центра субстрата приведет к образованию показанного аддукта. Последующее элиминирование и таутомеризация дадут продукт. В качестве начального продукта может образоваться также эпоксид [уравнение (10-54)].
б. Восстановленные птеридины в роли косубстратов
В ходе функционирования одной из групп гидроксилаз, включающей фенилаланингидроксил азу из печени человека, в качестве косубстрата выступает дигидроформа биоптерина (стр. 277), которая восстанавливается под действием NADPH [уравнение (10-52)].
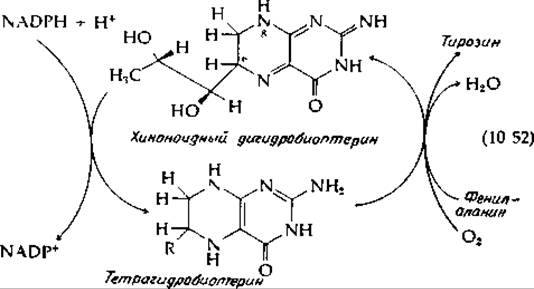
Образующийся тетрагидробиоптерин по структуре сходен с восстановленным флавином. Механизм его взаимодействия с О2 и гидроксилирования фенилаланина в тирозин в основном, возможно, такой же, как и в случае 4-оксибензоат — гидроксилазы. Дигидробиоптерин может существовать в виде ряда изомеров. Хиноноидная форма, представленная в уравнении (10-52), является таутомером 7,8-дигидробиоптерина — эта форма образуется при участии дигидрофолатредуктазы (гл. 8, разд. Л,2). Возможно, читатель сможет сам решить, какие аргументы свидетельствуют в пользу структуры, изображенной в уравнении (10-52) [143, 144]. Реакцию, находящуюся в левой части уравнения (10-52), катализирует пиридиннуклеотидзависимая дигидроптеридинредуктаза [145].
Фенилаланингидроксилаза представляет особый интерес, поскольку с ее отсутствием связано одно из наиболее изученных наследственных биохимических нарушений — фенилкетонурия (гл. 14, разд. 3,5). Известны и другие птеридинзависимые гидроксилазы. Например, триптофангидроксилаза мозга образует 5-окситриптофан, что является первой стадией синтеза нейромедиатора 5-окситриптамина (гл. 16, разд. Б,4) [146].
в. Миграция, индуцируемая гидроксилированием
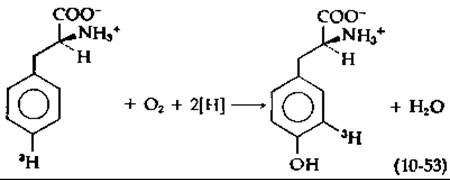
Общим результатом ферментативного гидроксилирования ароматических соединений является внутримолекулярная миграция атома водорода, или замещающего атома, или группы [уравнение (10-53)] [147]. Названная NIH-сдвигом (открывшие ее исследователи работали в лаборатории Национального института здоровья — National Institutes of Health), эта миграция позволяет судить о возможных механизмах гидроксилирования. В уравнении (10-53) присоединение гидроксильной группы вызывает перемещение атома трития. Эту миграцию можно представить как результат электрофильной атаки на ароматическую систему, например, ионом ОН+ [уравнение (10-54)];
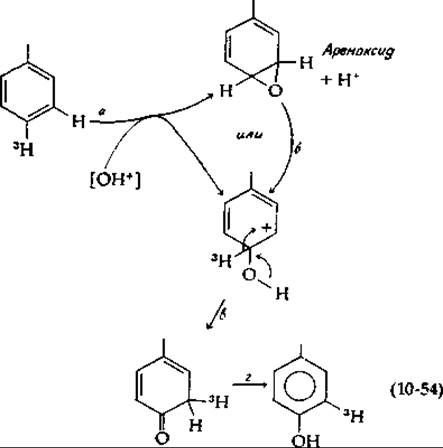
В результате такой атаки может образоваться эпоксид (ареноксид, стадия а) или сразу же карбоний-ион со структурой, изображенной в уравнении (10-54). Были получены ареноксиды и было показано, что они могут превращаться (вероятно, через стадию образования карбоний-иона, стадия б) в конечные продукты и что при этом наблюдается NIH-сдвиг [148, 149]. Таким образом, либо карбоний-ионы, либо ареноксиды являются по логике процесса первоначальными продуктами атаки на ароматические субстраты. Эти результаты позволяют предположить, что гидроксилирующий реагент имеет электрофильный характер — это свойство, по-видимому, присуще и рассматривавшимся выше гидроперекисям, супероксидиым анионам, оксазиридиновым промежуточным соединениям и молекуле О2, координационно связанной с ионом металла.
Примером NIH-сдвига, при котором мигрирует более крупный заместитель, является гидроксилирование пара-оксифенилпировиноградной кислоты [уравнение (10-55)]—ключевая стадия метаболизма тирозина.
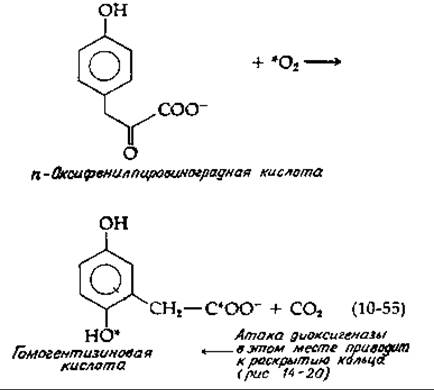
Эту реакцию следует сравнить с реакцией, приведенной в уравнении (8-67). Несомненно, обе они идут по сходному механизму. На первой стадии активированный кислород может присоединяться сначала к карбонильной группе, а затем другой конец молекулы О2 в результате электрофильной атаки присоединяется к ароматическому кольцу. Заметим, что этой атаке способствуют электронодонорные свойства n-гидроксильной группы. Последующее декарбоксилирование разрывает связь О—О, как и в уравнении (8-67). Одновременно, как и в уравнении (10-54), образуется гидроксилированный карбоний-ион, в котором происходит NIH-сдвиг. Хотя рассматриваемый фермент является диоксигеназой, механизм его действия, по-видимому, сходен с механизмом действия монооксигеназ.
г. а-Кетоглутарат в роли декарбоксилируемого косубстрата
Имеется группа монооксигеназ, способных принимать атомы водорода от а-кетоглутарата, декарбоксилируемого в этом процессе в сукцинат. Два из этих ферментов участвуют в гидроксилировании остатков лизина и пролина в предшественнике коллагена — проколлагене (гл. 11, разд. Д,3). Еще один фермент гидроксилирует у-бутиробетаин с превращением его в карнитин (гл. 9, разд. А,6). Все эти ферменты содержат Fe(II). Механизм, вероятно, близок к тому, который приведен в уравнении (10-55) [150, 151]: с одной стороны, активированный кислород присоединяется к карбонильной группе а-кетобутирата (нуклеофильное присоединение), а с другой — осуществляет электрофильную атаку гидроксилируемого субстрата [уравнение (10-56)]:
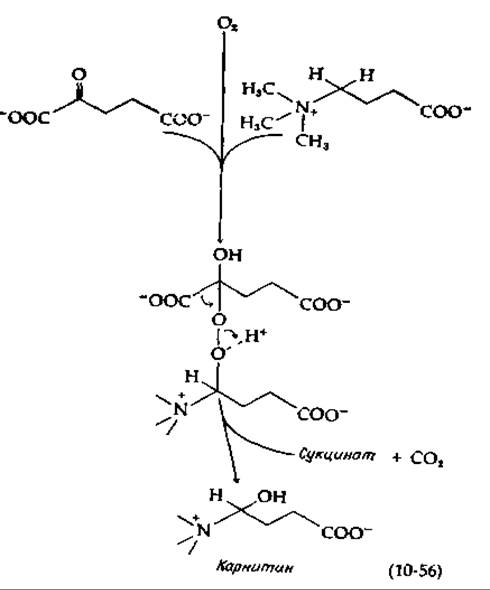
Возможен и другой путь: связанный с металлом кислород может реагировать с кетоглутаратом с декарбоксилированием последнего в перянтарную кислоту, которая может выступать в роли гидроксилирующего реагента [151а]:
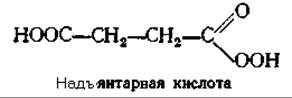
д. Аскорбиновая кислота в роли косубстрата
Многие гидроксилазы нуждаются в присутствии восстанавливающего агента. Чаще всего в этом отношении наиболее эффективна аскорбиновая кислота (витамин С; дополнение 10-Ж). Это справедливо и для всех а-кетоглутаратзависимых гидроксилаз, обсуждавшихся в предыдущем разделе. Аскорбиновая кислота, по-видимому, служит для поддержания металлсодержащего катализатора в восстановленном состоянии. Однако фермент дофамин-β-гидроксилаза использует аскорбиновую кислоту в роли истинного косубстрата при синтезе норэпинефрина [норадреналина; уравнение (10-57)] [152].
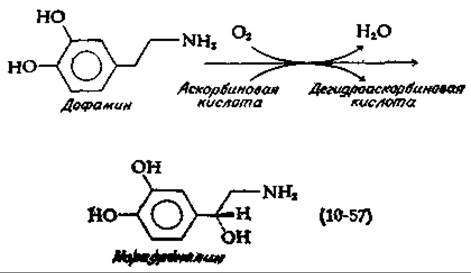
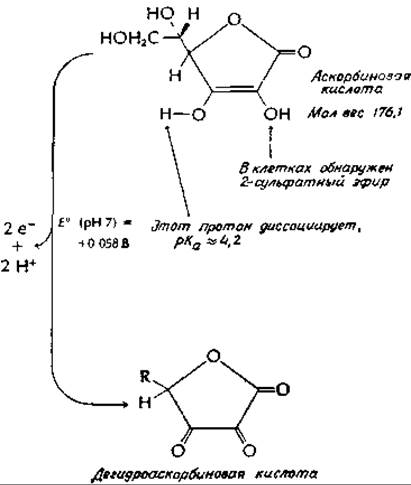
Эта реакция, играющая важную роль в нейронах мозга, активно протекает также в надпочечниках. Уже давно известно, что надпочечники особенно богаты аскорбиновой кислотой. Структура окисленной формы витамина С, дегидроаскорбиновой кислоты, показана в дополнении 10-Ж. Дофамин-β-гидроксилаза содержит несколько атомов меди, и полагают, что аскорбиновая кислота восстанавливает два атома меди из состояния +2 в состояние +1. Затем присоединяется О2 — возможно, подобно тому, как он присоединяется к гемоцианину (разд. Б,4). В результате образуется нечто подобное координационно связанному с металлом иону О2-2, который используется в реакции гидроксилирования. Следует упомянуть, что на молекулу витамина С оказывает действие еще и другой медьсодержащий фермент (оксидаза аскорбиновой кислоты; дополнение 10-3).
Дополнение 10-Ж
Витамин С: аскорбиновая кислота
У древних мореплавателей, заболевших цингой, кровоизлияния в коже, деснах и в суставах служили предвестником близкой смерти. Хотя где-то на рубеже 1700 г. удалось заметить, что развитие болезни может быть приостановлено, если питаться цитрусами, прошло еще 200 лет, прежде чем стали предприниматься попытки выделить витамин С. Впервые в кристаллическом виде аскорбиновая кислота была получена примерно в 1930 г. Об этих исследованиях очень живо и интересно рассказывает Сент-Дьердьна.
Среди млекопитающих только человек и морская свинка должны получать аскорбиновую кислоту с пищей; другие виды умеют ее синтезировать сами. Потребность в витамине С велика по сравнению с другими витаминами. Чтобы предотвратить цынгу, требуется 10 мг витамина в день, однако и при таком уровне потребления наблюдаются определенные клинические симптомы, например хрупкость мелких капилляров кожи. В разного рода «официальных» рекомендациях принятая доза витамина С составляет от 30 до 70 мг/день. Горячие споры в последнее время ведутся вокруг рекомендаций Лайнуса Полинга потреблять по 0,25—10 г аскорбиновой кислоты в деньб. Полинг и его последователи придерживаются той точки зрения, что аскорбиновая кислота оказывает специфическое действие, препятствуя развитию обычной простуды или ослабляя ее течениев. С другой стороны, критики придерживаются мнения о том, что высокие дозы этого, казалось бы, безобидного соединения могут приводить к малоизвестным опасным побочным эффектам. Хотя аскорбиновая кислота обладает антиоксидантными свойствами, в присутствии ионов трехвалентного железа она способствует образованию свободных радикалов, слишком высокое содержание которых может привести к неблагоприятным последствиям.
Биохимические функции аскорбиновой кислоты изучены не полностью. Помимо хорошо установленных восстановительных свойств и ее легкого окисления в дегидроаскорбиновую кислоту (структура изображена на стр. 442) известно также, что она представляет собой слабую кислоту, способную комплексироваться с металлами. Аскорбиновая кислота в очень высоких концентрациях присутствует в надпочечниках, где одной из ее функций может являться роль косубстрата для дофамин-β-гидроксилазы [уравнение (10-57)]. Вероятно участие аскорбиновой кислоты в гидроксилировании проколлагенав(раз. Ж,2,д), и не исключено, что предотвращение простуды как раз и обусловлено повышенным гидроксилированием коллагена. В опытах с морской свинкой было показано, что при высоком содержании аскорбиновой кислоты происходит более быстрое заживление ранг,д.
Аскорбиновая кислота вместе с Fe(II) и О2 служит мощным неферментативным гидроксилирующим реагентом для ароматических соединенийе,ж. Как и гидроксилазы, этот реагент атакует нуклеофильные участки (например, в процессе превращения фенилаланина в тирозин). Атомы кислорода 18О2 включаются в гидроксилированные продукты. Хотя в реакционной смеси образуется Н2О2, заменить аскорбат она не может. Однако не ясно, какое отношение эта система имеет к биохимическим функциям аскорбата.
а Szent-Gyоrgyi A., Annu. Rev. Biochem., 32, 1—14 (1963).
б Pauling І., Vitamin C and the Common Cold, Freeman, San Francisco, California, 1970
в Barnes M. J, Kodicek E., Vitam. Horm. (N. Y.), 30, 1—43 (1972).
г Yew M.-L. S., PNAS, 70, 969—972 (1973).
д Harwood R., Grant M. E., Jackson D. S., BJ, 142, 641—651 (1974).
е Ullrich V., Standinger H., Block K., Hayaishi O., eds., Biological and Chemical Aspects of Oxygenase, pp. 235—249, Maruzen, Tokyo, 1966.
ж Hamilton G. A., Workman R. J., Woo L., JACS, 86, 3391—3392 (1964).
e. Гидроксилирование с участием цитохрома P-450
Последний класс гидроксилаз образуют гемпротеиды, получившие общее наименование цитохрома Р-4501). Эти белки участвуют в гидроксилировании стероидов [153] и алканов [154, 155], в гидроксилировании метиленовой группы камфоры [156]. Они также участвуют в метаболизме различных лекарственных соединений [135, 157, 158]. Соответствующие реакции характеризуются следующими свойствами. Гидроксильная группа вводится без инверсии конфигурации [уравнение (10-58)].
1) Цитохром Р-450 назван так потому, что в восстановленной форме он образует пигмент, комплекс которого с окисью углерода поглощает при 450 нм.
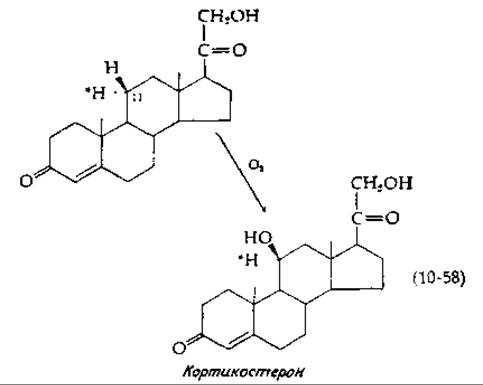
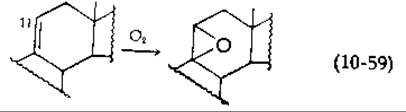
В этом уравнении представлено 11ß-гидроксилирование стероида — существенная стадия биосинтеза стероидных гормонов. Другой особенностью 11ß-гидроксилазной системы является то, что тот же фермент, который катализирует реакцию, описываемую уравнением (10-58), превращает ненасыщенное производное в эпоксид [уравнение (10-59)].
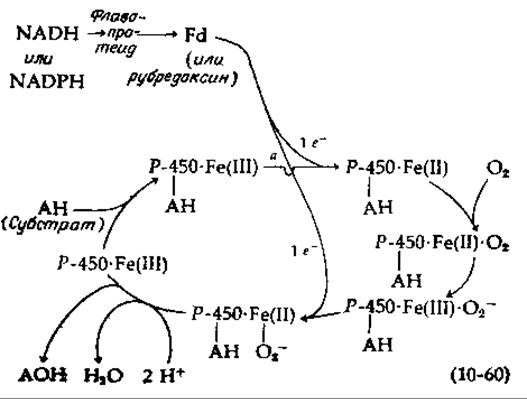
При функционировании цитохром P-450-гидроксилаз происходит перенос электронов от NADH или NADPH, через флавопротеид и далее на ферредоксин (Fd) или рубредоксин. По-видимому, один из этих последних белков, содержащих негемовое железо, затем восстанавливает железо, входящее в комплекс субстрата с цитохромом Р-450, из Fe (III)-состояния в Fe (II)-состояние [уравнение (10-60), реакция а]. Далее к иону двухвалентного железа присоединяется кислород, окисляющий его в феррисостоянне. В этот момент из цепи переноса электронов поступает еще один электрон. Координационно связанный кислород О-2 или O2-2~ атакует субстрат, и цитохром Р-450 освобождается в Fe (ІІІ) -состоянии. Хотя подробности этого процесса неизвестны, во всех случаях должна функционировать какая-то весьма сходная цепь реакций.
Известно несколько форм цитохрома Р-450 из печени млекопитающих [135]. Все они прочно связаны с мембранами эндоплазматического ретикулума и их трудно солюбилизировать. Для этих ферментов в качестве промежуточного переносчика не требуется белок типа рубредоксина, поскольку они могут непосредственно реагировать с флавопротеидом. Интересной особенностью этих ферментов является их индуцибельность. Введение различных лекарственных препаратов, например фенобарбитала и многих других соединений, может вызывать 20-кратное увеличение активности цитохрома Р-450. Ароматические углеводороды индуцируют гидроксилазу, отличную от той, которая индуцируется барбитуратами. Роль цитохрома Р-450 часто заключается в том, чтобы превратить лекарственное или другое чужеродное соединение в легко экскретируемую форму. Однако результат оказывается далеко не всегда благоприятным. Так, 3-метилхолантрен, сильный индуктор цитохрома Р-450, в результате реакции гидроксилирования превращается в мощный канцероген [159].
Дополнение 10-3
Белки, содержащие медь
Несмотря на многообразие функций меди в живых организмаха, лишь в 1924 г. стало ясно, что этот элемент является необходимым компонентом пищи. Медь настолько широко распространена в пищевых продуктах, что не было зарегистрировано случаев, чтобы у человека наблюдались признаки ее недостаточности. Недостаточность меди изредка встречается у животных: иногда вследствие того, что поглощению Сu2+ препятствует Zn2+, а иногда из-за связывания меди молибдатом в виде инертного комплекса. Имеются бедные медью пустынные земли в Австралии, где не выживают ни растения, ни животные. У животных с недостатком меди развиваются нарушения в костях. Обесцвечиваются волосы, нарушается и синтез гемоглобина. Весьма низка у них активность цитохромоксидазы. Белок эластин из артериальных стенок имеет мало поперечных связей, и артерии оказываются непрочными.
Организм взрослого человека получает ~2—5 мг меди в день, из которых усваивается около 30%. Общее содержание меди в организме человека составляет ~100 мг, причем как поглощение, так и выделение меди (в составе желчи) строго регулируются. Поскольку избыток меди оказывает токсическое действие, эта регуляция очень важна. Известно заболевание (болезнь Вильсона), при котором медь накапливается в печени и в мозге. Нормальное содержание меди в этих тканях составляет ~10-4 г-атомов на 1 л. Для большей части хелатных центров двухвалентный ион меди отзывается наиболее прочно связывающимся ионом металла (табл. 4-2), чем и объясняется тот факт, что медь в живых клетках почти целиком находится в комплексе с белками.
Ионы меди входят в активные центры большого числа самых разных катализаторова-г. Подобно железу, ион меди является участком, в котором происходит взаимодействие с О2. Способность подвергаться обратимому восстановлению позволяет ему функционировать в различных окислительно-восстановительных процессах. Простейшая функция медьсодержащих белков (как и в случае цитохрома с) — функция одноэлектронного переносчика. Бактериальные азурины являются ярко-голубыми белками низкого молекулярного веса, которые, как предполагают, функционируют в цепях переноса электронов. «Голубой белок» из Pseudomonas aeruginosa имеет мол. вес 16 300 и содержит один ион Сu2+ на молекулу. Спектр поглощения этого ярко-голубого белка приведен на рис. 13-8. Голубой цвет является признаком иона Сu2+; он проявляется и у гидратированного иона Сu(Н2О2+4 и еще более интенсивно — у иона Сu(NН3)2+4. Этот цвет, развивающийся вследствие перехода электрона с одной d-орбитали на другую внутри атома меди, выражен еще более интенсивно в медных пептидных хелатах, один из которых показан в уравнении (4-38). В красивых голубых белках интенсивность (d-d)-полос поглощения на порядок выше, чем в простых соединениях, — этот факт еще не получил полного объяснения. Не исключена возможность координации с одним или несколькими атомами серы боковых цепей метионинад.
К низкомолекулярным голубым белкам относится стеллацианин, медьсодержащий мукопротеид из японского лакового деревае. Этот пептид, построенный из 108 аминокислотных остатков, содержит 20% углеводов и один атом меди. Пластоцианин, впервые выделенный из водоросли Chlorella, впоследствии был обнаружен у всех зеленых растений. Считается, что он функционирует в цепи переноса электронов между двумя светопоглощающими центрами, входящими в систему фотосинтеза (гл. 13, разд. Д, 6).
Большая часть медьсодержащих белков реагирует с О2. Иногда эта реакция обратима, как, например, в случае переносчика кислорода гемоцианина (гл. 10, разд. Б, 4). Однако чаще кислород вступает в химическую реакцию, будучи «активированным». Одна группа ферментов параллельно с дегидрированием органических субстратов восстанавливает кислород в Н2О2. Так, галактозооксидаза (из Polyporus) катализирует превращение 6-оксиметильной группы галактозы в альдегидную группуж,з:
![]()
Большая полипептидная цепь этого фермента с мол. весом 68 000 содержит один атом меди. В отличие от голубых белков галактозооксидаза имеет темно-зеленый оттенок. Хотя ни кислород, ни галактоза в отдельности не меняют спектра фермента, присутствуя совместно, они изменяют спектр. Полагают, что галактоза и О2 могут связываться с медью, которая при этом может переходить из состояния Cu(I) в состояние Cu(III) и обратно. Сходный механизм, вероятно, характерен для тирозиназы (см, ниже)з. Галактозооксидаза использовалась для модифицирования гликопротеидов поверхности наружной клеточной мембраны. Экспонированные галактозильные или N-ацетилгалактозаминильные остатки окислялись ферментом в соответствующие С6-альдегиды, а последние восстанавливались в мягких условиях тритийсодержащим боргидридом натрияе.
Аминоксидазы, содержащие и Сu2+, и флавиновые коферменты, по своему действию сходны с оксидазами аминокислот (табл. 8-4). Одна из этих аминоксидаз превращает ε-аминогруппы боковых цепей лизина в альдегидные группы в коллагене и эластине (гл. 11, разд. Д, 3). Другим медьсодержащим ферментом является уратоксидаза, вызывающая декарбоксилирование своего субстрата (рис, 14-33).
Некоторые медьсодержащие ферменты, например дофамин-ß-гидроксилаза [уравнение (10-57)], являются типичными гидроксилазами. Из медьсодержащих гидроксилаз широко распространена тирозиназа (известная также как полифенолоксидаза); она катализирует двухстадийную реакцию гидроксилирования с последующим дегидрированием. Впервые идентифицированный в грибах, этот фермент был также выделен из японского лакового дерева. Он в больших количествах присутствует в растительных тканях и вызывает потемнение сорванных фруктов. У животных тирозиназа участвует в синтезе диоксифенилаланина (ДОФА) и в образовании черного пигмента меланина кожи и волос. Недостаток этого фермента или его блокирование в меланоцитах (клетках, продуцирующих меланин) приводит к альбинизму. Тирозиназа из гриба Polyporus имеет мол. вес ~120 000 и содержит четыре субъединицы. В каждой из субъединиц содержится один атом Cu(I).
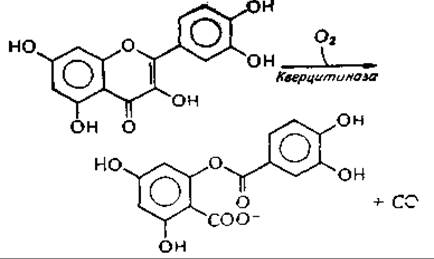
Необычную реакцию катализирует медьсодержащая кверцитиназа из Aspergillus flavus.
Фермент следует причислить к оксигеназам. Реакция приводит к образованию СО; наиболее вероятный механизм включает образование промежуточного перекисного соединенияк,л.
Голубые медьсодержащие оксидазым являются необычными катализаторами в том отношения, что они могут восстанавливать оба атома молекулярного кислорода до Н2О. Этим они напоминают цитохромоксидазу (которая также содержит медь; разд. Б, 5), но они не содержат железа. Оксидаза аскорбиновой кислоты из растительных тканей превращает аскорбат в дегидроаскорбат (дополнение 10-Ж). При добавлении к этому ферменту субстрата голубой цвет фермента блекнет, и можно показать, что медь в этом случае восстанавливается в (+1)-состояние. Лакказа из сока японского лакового дерева или из гриба Polyporus катализирует такое же превращение субстратов, как и тирозиназа, но продуктом вместо перекиси водорода является Н2О. У фермента из Polyporus, который в отличие от тирозиназы нечувствителен к СО, молярная экстинкция при 610 нм >1000. Было показано, что лакказа содержит но меньшей мере три типа ионов меди. Один имеет голубой цвет, как у молекулы типа азурина, и связывает кислород. Другой ион меди не имеет голубого цвета и, вероятно, служит центром связывания анионов — возможно, это необходимо для стабилизации образующейся на промежуточной стадии перекиси. Два других иона Сu2+ образуют диамагнитную пару, которая служит двухэлектронным акцептором, получающим электроны от субстрата и затем передающим их на кислород, очевидно, с промежуточным образованием перекиси.
Церулоплазмин представляет собой голубой белок с мол. весом ~ 150 000 и содержит 8 ионов Сu+ и 8 ионов Сu2+. Это главный медьсодержащий белок крови, и на его долю приходится 3% общего содержания меди в организме. Церулоплазмин, по-видимому, каким-то образом связан с регуляцией содержания меди в организме; так, при болезни накопления меди (болезни Вильсона) содержание церулоплазмина оказывается низким. Кроме того, церулоплазмин обладает ферментативными свойствами, напоминая в этом отношении лакказу; он тоже может катализировать окисление Fe2+ в Fe3+. Последняя реакция имеет важное значение, поскольку лишь Fe3+ может присоединяться к транспортирующему железо белку трансферрину (дополнение 14-Г). По этой причине церулоплазмин иногда называют ферроксидазой.
Широко распространенную группу образуют белки, называемые эритрокупреинами, цереброкупреинами и т. д.; первоначально они рассматривались как белки, предназначенные для запасания медии. Однако в последние годы выяснилось, что эти белки являются супероксиддисмутазами [уравнение (8-61)]. В цитоплазме эукариот эти ферменты присутствуют в виде димеров с мол. весом 31 300; каждая субъединица содержит один атом меди и атом цинка. Предполагается, что медь связана с тремя атомами азота имидазольной группы. Вероятно, она подвергается последовательному окислению и восстановлению в реакции с перекисными радикалами. Установлена кристаллическая структура этого фермента, так что вскоре станет известна более детальная картина окружения, в котором в этом ферменте находится медьо.
Помимо этих супероксиддисмутаз, содержащих медь и цинк, в митохондриях и во многих бактериях содержатся марганецсодержащие ферменты, выполняющие ту же функцию (дополнение 13-А). В клетках Е. coli имеются как марганец-, так и железосодержащие супероксиддисмутазыи.
Описан также цитоплазматический медьсвязывающий белокр, напоминающий металлотионеин (дополнение 7-Е) как высоким содержанием цистеина, так и некоторыми другими свойствами.
а Frieden Е., Sсi. Am., 218, 103—114 (1968).
б O’Dell В. L., Campbell В. J., Compr. Biochem., 21, 191—203 (1971).
в Peisach J., Aisen P., Blumberg W. E., eds., Biochemistry of Copper, Academic Press, New York, 1966.
г Malkin P., Malmström В. G., Adv. Enzymol., 33, 177—244 (1970).
д Jones T. E., Rorabacher D. B., Ochrymowycz L. A., JACS, 97, 7485—7486 (1975).
е Peisach J., Levine W. G., Blumberg W. E., JBC, 242, 2847—2858 (1967).
ж Etlinger M. J., Kosman D. J., Biochemistry, 13, 1247—1251 (1974).
з Dyrkacz G. D., Libby R. D., Hamilton G. H., JACS, 98, 626—628 (1976).
и Gahmberg C. G., JBC, 251, 510—515 (1976).
к Krishnamurty H. G., Simpson F. J., JBC, 245, 1467—1471 (1970).
л Vanneste W. H., Zuberbühler A. In: Molecular Mechanisms of Oxygen Activation (O. Hayaishi, ed.), pp. 371—404, Academic Press, New York, 1974.
м Fee J. A., Struct. Bonding (Berlin), 23, 1—60 (1975).
н Weser U., Struct. Bonding (Berlin), 17, 1—65 (1973).
о Thomas K. A., Rubin В. H., Bier C. J., Richardson J. S., RichardsonD. C., JBC, 249, 5677—5683 (1974).
п Yost F. J., Jr., Fridovich I., JBC, 248, 4905—4908 (1973).
p Wingle D. R., Premakumar R., Wiley R. D., Rajagopalan К. V., ABB, 170, 253—266 (1975).