Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Биосинтез полимеров и их модификация
Характерные особенности биосинтеза
Наиболее специфическими компонентами живых клеток являются биополимеры. Образование и химическая модификация этих гигантских молекул и их участие в катаболизме, в процессе которого они проходят через последовательность необратимых реакций — все это происходит обычно в пределах одной клетки. Кроме того, обратимые изменения, которым полимеры подвергаются в клетке, играют важную роль в регуляции метаболизма.
При сборке биополимеров возникают по меньшей мере три химические проблемы. Первая из них состоит в преодолении термодинамических барьеров, вторая — в регуляции скорости их синтеза и третья — в обеспечении требуемого строения или последовательности, в которой мономерные звенья связаны друг с другом. Рассмотрим кратко наиболее важные способы активации групп, участвующих в полимеризации, и сам процесс полимеризации.
а. Аминокислоты и пептиды
Активация аминокислот, необходимая для их включения в олигопептиды и белки, может осуществляться с участием ацильных групп двумя способами, показанными в табл. 7-2. В первом из них SlC(y) образуется ацилфосфат, который реагирует с аминогруппой, образуя пептидную связь. Этим способом в две стадии образуется трипептид глутатион (дополнение 7-Ж).
При втором способе [SlC(а); табл. 7-2] образуются аминоациладенилаты [«активированные» аминокислоты в уравнении (11-3)], которые могут переносить свои аминоацильные группы при помощи специфических молекул тРНК [уравнение (11-3)].
В ряде случаев перенос активированных аминоацильных групп осуществляется при помощи —SH-групп с образованием промежуточных тиоэфиров [табл. 7-2; SlA(а)]. Примером может служить синтез продуцируемого Bacillus brevis антибиотика грамицидина S, представляющего собой циклический декапептид, со следующей дважды повторенной последовательностью пяти аминокислот:
![]()
Растворимая ферментная система, ответственная за синтез этого антибиотика, состоит из крупного белка с мол. весом 280 000, который активирует аминокислоты в виде аминоациладенилатов и переносит их на тиоловые группы молекул 4'-фосфопантетеина, ковалентно связанные с ферментом [26, 27]. Таким образом, обеспечивается связывание четырех аминокислот, а именно пролина, валина, орнитина (орнитин см. на рис. 14-2) и лейцина. Активацию фенилаланина обеспечивает другой фермент (мол. вес. 100 000). Формирование полимера инициируется, вероятно, активированным фенилаланином1) и осуществляется аналогично тому, как это имеет место в процессе удлинения цепи жирных кислот (разд. Г,6). Инициация происходит в то время, когда аминогруппа активированного фенилаланина (на втором ферменте) атакует ацильную группу аминоацилтиоэфира, при помощи которой удерживается активированный пролин. Затем свободная аминогруппа пролина атакует активированный валин и т. д., в результате чего образуется пентапептид. После этого две молекулы пентапептида связываются друг с другом, и процесс образования антибиотика завершается замыканием цикла. Последовательность аминокислот в антибиотике строго специфична, и замечательным является тот факт, что эта сравнительно небольшая ферментная система оказывается способной осуществлять все стадии процесса в требуемой последовательности. Аналогичным путем синтезируются также и некоторые другие пептидные антибиотики — тироцидины и полимиксины.
1) На определенной стадии процесса L-фенилаланин изомеризуется в D-фенилаланин.
В отличие от биосинтеза грамицидина S, специфичность процесса полимеризации в котором обеспечивается ферментами, синтез белков (так же, как и нуклеиновых кислот) осуществляется с помощью матричного механизма. Нужная последовательность мономерных единиц в синтезируемом полимере реализуется в соответствии с генетическим кодом, и в природе можно обнаружить почти бесконечное число разных последовательностей. Ключевой реакцией в образовании белков является перенос активированных аминоацильных групп на молекулы тРНК [уравнение (11-2)], которые выполняют функцию переносчиков или «адаптеров», как это детально изложено в гл. 15. Каждый фермент, активирующий аминокислоту (аминоацил-тРНК-синтетаза), должен правильно узнавать свою тРНК и присоединять к ней «правильную» аминокислоту. Затем тРНК переносит активированную аминокислоту к рибосоме и помещает ее в нужный момент в активный участок, после чего в результате реакции, носящей название трансацилирования, аминокислота присоединяется к растущей полипептидной цепи.
б. Полисахариды
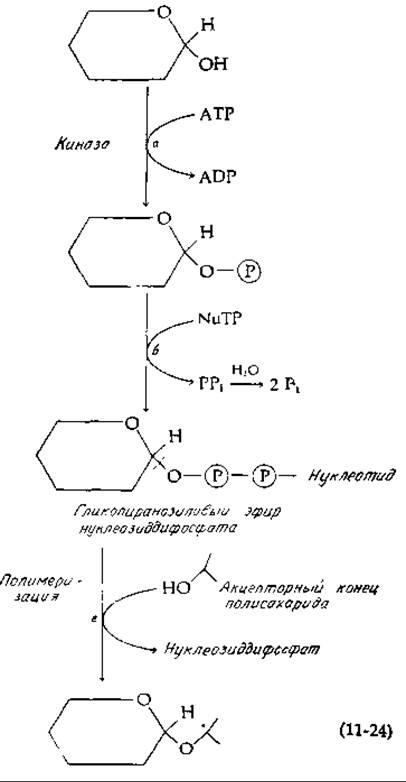
Включение сахарного мономера в полисахарид требует обычно расщепления двух высокоэнергетических фосфатных связей АТР. Однако для процесса активации углеводов характерны некоторые специфические особенности [уравнение (11-24)]. Сначала сахар фосфорилируется киназой [уравнение (11-24), стадия а], после чего от нуклеотидтрифосфата (NuTP) с помощью второго фермента отщепляется пирофосфат и образуется гликопиранозиловый эфир нуклеозиддифосфата, известный под названием сахаронуклеотида [уравнение (11-24), стадия б]. Неорганический пирофосфат гидролизуется при помощи пирофосфатазы, тогда как сахаронуклеотид используется в качестве промежуточного донора активированной гликозильной группы при полимеризации [уравнение (11-24), стадия в]. На стадии полимеризации гликозильная группа переносится с замещением нуклеозиддифосфата. Таким образом, суммарный процесс сначала включает расщепление АТР до ADP и Pi, затем расщепление нуклеозидтрифосфата до нуклеозиддифосфата плюс Pi. Нуклеозидтрифосфатом на стадии б [уравнение (11-24)] иногда является сам АТР. В этом случае суммарный результат состоит в расщеплении двух молекул АТР до ADP. Однако, как показано в гл. 12, перенос активированных гликозильных единиц может осуществляться самыми разными нуклеотидными «ручками».
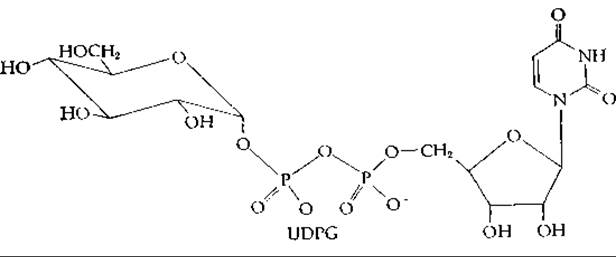
Первым открытым сахаронуклеотидом была уридиндифосфатглюкоза (UDPG). Это соединение открыл Лелуар приблизительно в 1950 г. при исследовании процесса превращения галактозо-1-фосфата в глюкозо-1-фосфат [28]: это и другие взаимопревращения гексоз происходят на сахаронуклеотидном уровне. Однако в то время это еще не было известно. Исследования привели Лелуара к открытию UDP-глюкозы и UDP-галактозы, за что в 1970 г. ему была присуждена Нобелевская премия.
Что определяет характер включения сахарных единиц в полисахариды? Некоторые гомополисахариды, такие, как, например, целлюлоза и линейная форма крахмала (амилоза), содержат только один моносахаридный компонент и только в одном типе связи. Для образования таких цепей один фермент может добавлять одну единицу активированного сахара ко второй со стороны растущего конца. В отличие от этого для сборки молекулы гликогена необходимы по крайней мере два фермента. Одним из них является синтетаза, катализирующая перенос активированных глюкозильных единиц от UDP-глюкозы к растущему концу полимера, а другим — трансгликозилаза, выполняющая функцию ветвящего фермента. После того как длина концов цепи достигнет приблизительно десяти единиц, ветвящий фермент атакует гликозидную связь в каком-нибудь месте цепи. Действуя аналогично гидролазе, он образует, по-видимому, промежуточное соединение, которое представляет собой гликозилфермент или стабилизированный карбоний-ион. В любом случае фермент не освобождает оторванный фрагмент цепи (как это имеет место в случае а-амилазы; гл. 7, разд. В,6), а переносит его к другому, близко расположенному активному участку молекулы гликогена. Здесь фермент снова присоединяет связанную с ним цепь к свободной 6-гидроксильной группе гликогена, создавая таким образом новую ветвь, присоединенную при помощи а-1,6-связи.
Другие углеводные полимеры состоят из повторяющихся олигосахаридных единиц. Так, в гиалуроновой кислоте единицы глюкороновой кислоты чередуются с единицами N-ацетил-О-глюкозамина. О-антигены оболочек бактериальных клеток (гл. 5, разд. Г, 1) содержат повторяющиеся субъединицы приблизительно пяти различных сахаров. В этих случаях характер полимеризации может быть установлен по специфичности индивидуальных ферментов. Фермент, способный присоединить активированную глюкозильную единицу к растущему полисахариду, может делать это только при условии, если необходимая структура достроена до этой точки (подробнее см, гл. 12, разд. В, 1).
в. Биосинтез нуклеиновых кислот
Активированные нуклеотиды представляют собой нуклеозид-5'-трифосфаты. Для синтеза РНК необходимы активированные рибонуклеотиды ATP, GTP, UTP и СТР, а для синтеза ДНК — 2'-дезоксирибонуклео- тидтрифосфаты dATP, dTTP, dGTP, dCTP. В любом случае добавление активированных мономерных единиц катализируется белком, который связан с нуклеиновой кислотой, выполняющей роль матрицы. Выбор требуемой нуклеотидной единицы, предназначаемой для ее включения в растущую цепь, определяется нуклеотидом, уже включенным в соответствующее место комплементарной цепи; этот вопрос рассматривается в гл. 15. Химия этого процесса состоит просто в вытеснении пирофосфата:
![]()
Заметим, что атом фосфора активированного нуклеозидтрифосфата атакуется всегда 3'-гидроксилом полинуклеотида. Таким образом, нуклеотидные цепи растут от 5'-конца, т. е. новые единицы всегда присоединяются к 3'-концу.
г. Характерные особенности сборки фосфолипидов
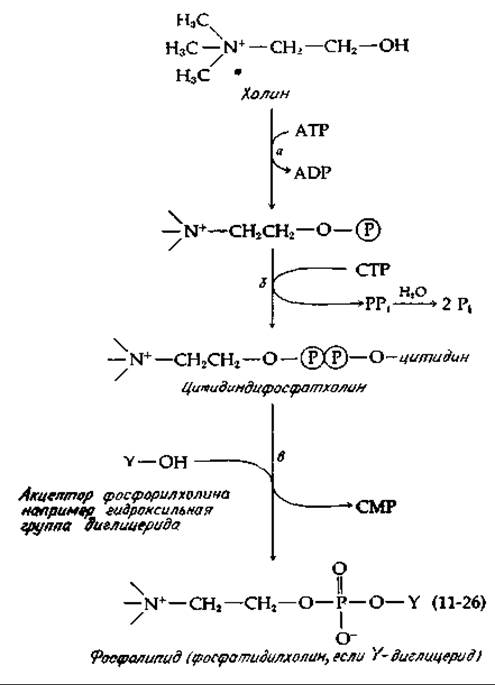
Характерная особенность биосинтеза липидов заслуживает того, чтобы прокомментировать ее здесь. Холин и этаноламин активируются аналогично тому, как это имеет место в случае сахаров [уравнение (11-26)]. Например, холин может быть фосфорилирован с использованием АТР [уравнение (11-26), стадия a], a образующийся фосфорилхолин может далее превращаться в цитидиндифосфатхолин [уравнение (11-26), стадия б]. В результате переноса фосфорилхолина из последнего соединения на подходящий акцептор образуется конечный продукт [уравнение (11-26), стадия в]. Следует отметить отличие этих реакций полимеризации от синтеза полисахаридов, которое состоит в том, что вступление в реакцию сахаронуклеотида сопровождается отщеплением целого нуклеозиддифосфата, тогда как в реакциях CDP-холина и CDP-этаноламина отщепляется СМР, а одна фосфатная группа остается в конечном продукте. То же самое имеет место в случае синтеза бактериальных тейхоевых кислот (гл. 5, разд, Г, 2). Сначала образуется CDP-глицерин или CDP-рибит, а после этого происходит полимеризация с отщеплением СМР и образованием чередующегося сахарофосфат-алкогольного полимера [28а].