Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Биосинтез полимеров и их модификация
Необратимая модификация и катаболизм полимеров
Синтезируемые в клетках полимеры подвергаются распаду. Например, полупериод жизни большинства белков в печени крыс и кроликов составляет всего лишь 1—8 дней [29, 30]. Что касается ферментов, то по крайней мере у одного из них полупериод жизни составляет всего лишь 11 мин, тогда как другие ферменты могут сохраняться в течение недель [31]. Если рассматривать разные виды живых организмов, то полупериоды жизни гомологичных белков оказываются приблизительно пропорциональными продолжительности жизни организма [32].
Ограниченное время жизни характерно также для большого числа липидных компонентов клеток, для рибонуклеиновых кислот и для полисахаридов всех мембран. Эти данные показывают, что внутри клеток существует непрерывный поток материи, который обусловливает возможность построения мембран и органелл клетки, а также постоянное обновление компонентов, из которых они построены. Этот поток материи определяется необратимыми перестройками полимеров, включая их окончательный гидролиз. Практически невозможно перечислить все известные в настоящее время модификации биополимеров, однако в следующих разделах мы попытаемся описать некоторые из них.
а. Реакции специфического гидролиза
Ферменты часто секретируются в виде проферментов, которые уже впоследствии подвергаются активации (гл. 6, разд. Е.2; гл, 7, разд.Г). Это относится также к сывороточному альбумину крыс [33] и к некоторым пептидным гормонам (гл. 16, разд А, 1), включая инсулин. Напомним, что последний состоит из одной A-цепи и одной В-цепи, соединенных друг с другом дисульфидными мостиками (рис. 4-13). Инсулин синтезируется в ß-клетках островков Лангерганса поджелудочной железы в виде проинсулина, состоящего из 84 аминокислотных остатков. Разрыв полипептидной цепи в проинсулине происходит, по-видимому, уже после его свертывания и образования дисульфидных связей (рис. 11-9) [34—36]. Аналогичным образом транспортные РНК рождаются из более длинных молекул РНК, транскрибируемых на ДНК-матрицах. В транскрибированных молекулах тРНК происходят целые серии модификаций, затрагивающих вполне определенные основания, после чего гидролитическое расщепление доводит молекулы до их окончательного размера. Молекулы информационной РНК в эукариотических клетках транскрибируются, судя по имеющимся данным, в виде гигантских длинных молекул, которые перед тем, как начать функционировать, разрезаются на более короткие куски (гл. 15, разд Б, 5).
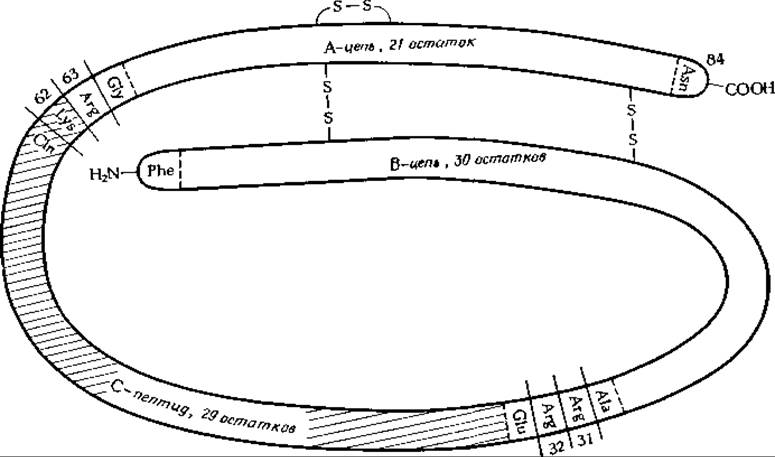
РИС. 11-9. Схематическое изображение структуры проинсулина. Удаление С-концевого пептида, содержащего 29 остатков, а также остатков основных аминокислот 31, 32, 62 и 63 приводит к образованию инсулина. Более детально отклонение инсулина показано на рис. 4-13.
б. Модификация при помощи реакций переносом групп
Белки, нуклеиновые кислоты и другие компоненты клеток модифицируются при помощи метилтрансфераз, которые переносят метильные группы от S-аденозилметионина к специфическим участкам в полимерах. Это явление впервые было описано в 1959 г., когда в белке жгутика Salmonella был обнаружен e-N-мeтиллизин. С тех пор были выделены e-N-ди- и триметиллизины, а затем (ω-N-метиларгинин, 3-метилгистидин и др. [37]. Эти метилированные аминокислоты были обнаружены в гистонах, в мышечных белках, в белках мозга, а также в цитохроме с представителей некоторых видов. Известны ферменты, которые осуществляют перенос метильных групп на карбоксильные группы боковых цепей. Поскольку образующиеся при этом метиловые эфиры неустойчивы к гидролизу, вопрос о степени и о важности этого типа модификации белков остается неясным.
Другой тип модификации белков сводится к переносу лейцинового и (или) фенилаланинового остатка, от молекул тРНК непосредственно на определенные белки с изменением их структуры по сравнению с той, которой они обладали сразу же после их образования в рибосомах [38].
Более важным по сравнению с метилированием белков является метилирование нуклеиновых кислот. Если в молекулах ДНК избирательно метилируется лишь незначительная часть оснований (гл. 2, разд. Г, 8), то молекулы тРНК после синтеза подвергаются не только интенсивному метилированию, но также модификациям другого типа. Адениновые кольца могут метилироваться по атому N-1 или по —NH2-гpyппе. Метилированию подвергаются также урациловое, цитозиновое и гуаниловое основания, а в некоторых случаях и 2'-ОН-группы рибозных колец РНК. Из большого числа других, хорошо известных типов модификации отметим N-ацилирование и N-изопентенилирование адениновых колец (гл. 15, разд. Б, 4).
в. Модификация путем присоединения простетических групп
В некоторых случаях конечной стадией биосинтеза функционального активного белка является ковалентное присоединение простетической группы, участвующей в формировании активного участка фермента. Например, биотин и липоевая кислота ферментативно присоединяются к нуждающимся в них ферментам. Рибофлавин ковалентно связывается с некоторыми белками, а группа гема — с цитохромом с. Нековалентно связанные коферменты присоединяются к пептидным цепям в строго определенные моменты — вероятно, еще до завершения синтеза всей полипептидной цепи.