Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Биосинтез полимеров и их модификация
Гидроксилирование и другие модификации белков соединительных тканей
Коллаген, наиболее широко распространенный белок в организме, составляющий большую часть органической массы кожи, сухожилий, кровеносных сосудов, костей, роговицы и стекловидного тела глаз, а также мембран. Близкий по свойствам белок эластин был обнаружен в эластичных фибрилах соединительных тканей, содержащихся в связках и в стенках кровеносных сосудов. Коллаген синтезируется фибробластами и выделяется в межклеточное пространство, где он полимеризуется, образуя прочный долгоживущий материал [38а]. Внутриклеточный предшественник коллагена — проколлаген, так же как и зрелый коллаген (гл. 2, разд. Б, 3,в), содержит три цепи. Основная же форма коллагена в большинстве тканей большинства видов (коллаген I) содержит две а1(І)-цепи и одну а2-цепь, в связи с чем его обозначают как [а1(І)]2а2. Коллаген хрящей (коллаген II) содержит три а1-цепи и обозначается как [а1 (II)]3. Коллаген III, обнаруживаемый в различных тканях, особенно эмбрионов, имеет строение [а1(ІІІ)]3[38b].
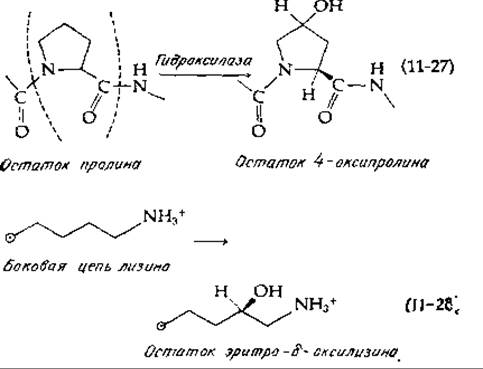
Каждая цепь проколлагена (мол. вес. 140 000) содержит более 1000 аминокислотных остатков. Специальные гидроксилазы (гл. 10, разд. Ж, 2, г) превращают некоторые из содержащихся в проколлагеновых цепях остатки пролина и лизина в 4-оксипролин и в оксилизин [уравнения (11-27) и (11-28)]. При этом образуется также 3-оксипролин, но в меньших количествах [38с]. Гидроксилирование начинается еще тогда, когда растущие пептидные цепи связаны с рибосомами, расположенными на шероховатом эндоплазматическом ретикулуме. Гидроксилазы локализованы, вероятно, в пузырьках эндоплазматического ретикулума (ЭР) [39].
Галактозильные единицы переносятся на некоторые гидроксильные группы боковых цепей оксилизина, а гликозильные группы переносятся затем на некоторые галактозильные группы. Три проколлагеновые цепи связываются друг с другом и образуют тройную спираль еще до их выделения из фибробластов. В межклеточном пространстве проколлаген подвергается действию двух специфических ферментов — проколлагенпептидаз, которые отщепляют с С-конца каждой из трех цепей полипептид с мол. весом приблизительно 35 000, а с N-конца каждой из трех цепей полипептид с мол. весом, равным приблизительно 20 000 [40—41]. Аминокислотный состав отщепляемых полипептидов существенно отличается от аминокислотного состава остающегося коллагенового мономера (называемого также тропоколлагеном), который на одну треть состоит из глицина и содержит много пролина. Эти концевые полипептиды связаны друг с другом в молекулах проколлагена дисульфидными мостиками, образующимися до их выделения из клеток [41а].
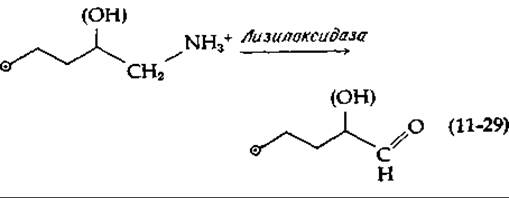
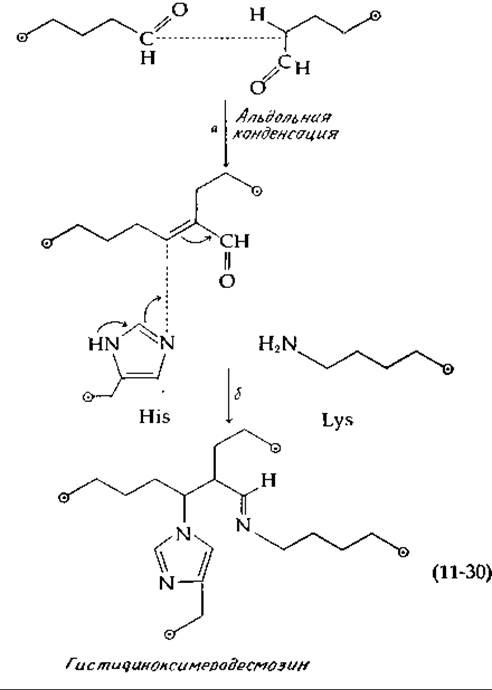
Мономеры коллагена представляют собой трехнитевые «тяжи» диаметром, равным приблизительно 1,5 нм и длиной 300 нм. Когда они достигают места своей окончательной локализации, они связываются друг с другом поперечными связями, образуя коллаген [40, 42—44]. Этот процесс инициируется окислением аминогрупп боковых цепей некоторых из остатков лизина и оксилизина до альдегидных групп, которое катализируется медьсодержащими оксидазами [уравнение (11-29); дополнение 10-3]. Альдегидные группы вступают в различные реакции, приводящие к поперечным связям между тропоколлагеновыми единицами и к образованию нерастворимых нитей. Одной из реакций является альдольная конденсация, сопровождающаяся отщеплением молекулы воды [уравнение (11-30), стадия а]. Если один из двух альдегидов, участвующих в альдольной конденсации, происходит от оксилизина, то образуются два изомерных продукта. Продукт альдольной конденсации может реагировать дальше: имидазольная группа боковой цепи гистидина может присоединиться к двойной углерод-углеродной связи, а боковая цепь лизина может образовать со свободным альдегидом шиффово основание. Результаты этих двух процессов видны из уравнения (11-30) (стадия б). В конечном продукте, гистидиноксимеродесмозине, связаны друг с другом четыре боковые группы разных аминокислотных остатков. В других случаях между альдегидом и ε-аминогруппами образуются простые шиффовы основания или происходят только две из трех реакций, приведенных в уравнении (11-30).
Поперечные связи, по-видимому, распределены не беспорядочно, а находятся в определенных положениях и часто располагаются в направлении концов мономеров коллагена. Остатки гистидина были обнаружены в полипептидных цепях только в положениях 89, 929 и 1034. Разнообразие и число поперечных связей варьируют при переходе от одного вида к другому.
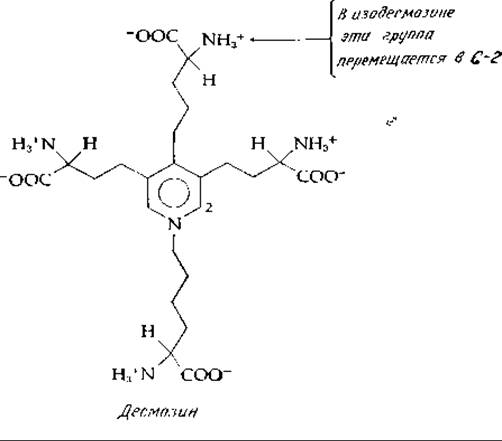
Поперечные связи необычного характера были обнаружены в эластине. Три альдегидные группы взаимодействуют с одной аминогруппой лизина при помощи реакций альдольной конденсации, дегидратации и окисления, образуя десмозин и изодесмозин. В нативной молекуле эластина все четыре аминогруппы и карбоксильные группы участвуют, по-видимому, в образовании пептидной связи. Читатель сам может представить себе механизмы биосинтеза десмозина и изодесмозина [43а].
Дополнение 11-Б
Генетические дефекты структуры коллагена
При изучении любого белка, играющего какую-то роль в функционировании организма, мы всегда сталкиваемся с генетическими проблемами. В случае коллагена возможность вредных мутаций повышается, поскольку этот белок кодируется больше чем одним набором генова,б. Было идентифицировано по меньшей мере четыре типа коллагена, характеризующихся вполне определенными различиями на молекулярном уровне, и было показано, что различные гены коллагена по-разному проявляют себя в разных тканях. Например, молекулы коллагена хрящей состоят преимущественно из трех идентичных a-цепей, отличающихся по аминокислотной последовательности от а1 и а2-цепей коллагена сухожилий и костей. Коллаген кожи маленьких детей и коллаген клапанов сердца и крупных артерий содержат полипептидные цепи двух других типов.
Четко выраженной наследственной аномалией коллагена является заболевание крупного рогатого скота дерматоспараксис, при котором кожа животного становится очень ломкой. Цепи коллагена при этом заболевании не обладают упорядоченной структурой и не способны поэтому образовывать фибриллы. Эта аномалия обусловлена дефектом проколлаген-пептидазы — фермента, отщепляющего пептиды с N-концов цепей коллагенав.
Коллагеновым заболеванием человека является синдром Элерса — Данлоса, который в ряде случаев сопровождается деформацией суставов и искривлением позвоночника. Одна из форм этого заболевания обусловлена недостатком проколлаген-пептидазыг, а другая — недостатком коллагена ІІІд. Содержание оксилизина в образующемся в этих условиях коллагене невелико, что препятствует образованию поперечных связейе. Если в организм животного с пищей попадают семена обычного сладкого горошка (Lathyris odoralus), то у них может наступить состояние латиризма. Поскольку люди употребляют сладкий горошек в пищу, это состояние наблюдается и у людей; обычно оно приводит к деформации позвоночника и к разрыву аорты. Установлено, что биохимический эффект семян сладкого горошка обусловлен наличием в них ß-цианаланина и продукта его декарбоксилирования ß-аминопропионитрилае:
![]()
Хотя точный механизм действия этого соединения неясен, есть основание считать, что оно является ингибитором лизилоксидазы — фермента, необходимого для образования поперечных связей в коллагене или в эластинеж. Аналогичного рода заболевание, передающееся по наследству, было обнаружено у мышей. Предполагается, что оно обусловлено или недостаточной активностью лизилоксидазы, или дефектом в метаболизме медид. В работег было высказано предположение, согласно которому одна из форм синдрома Элерса — Данлоса у людей вызвана недостаточной активностью лизилоксидазыг.
В настоящее время исследуется вопрос о влиянии аномалий в структуре коллагена на состояние суставов у человека. Было, например, показано, что при широко распространенном заболевании, остеоартрите, в хрящах вместо коллагена обычного типа [d1 (II)] з содержится коллаген, имеющий в своем составе а2-цепи, характеризующиеся пониженной степенью гликозилированияз. С другой стороны, в хрупких костях людей, страдающих одним из видов наследственного заболевания, проявляемого в нарушениях процесса остеогенеза, наряду с содержащимся обычно в костях коллагеном типа I содержится также коллаген типа ІІІг.
Согласно имеющимся данными, содержание коллагена I в фиброзных атеросклеротических бляшках артерий человека повышено по сравнению с его содержанием в стенках нормальных артерий (содержащих в основном коллаген типа III).
а Bailey А. J., Compr. Biochem., 26В, 297—423 (1968).
б Miller Е. J., Matukas V. J., Fed. Proc., Fed. Am. Soc. Exp. Biol., 33, 1197—1204 (1974).
в von der Mark K., Bornstein P., JBC, 248, 2285—2289 (1973).
г Müller P. K., Lemmen C., Gay S., Meigel W. N., EJB, 59, 97—104 (1975).
д Pope F. M. et al., PNAS, 72, 1314—1316 (1975).
e Bornstein P., Annu. Rev. Biochem., 43, 567—603 (1974).
ж Narayanan A. S., Siegel R. C., Martin G. R., BBRC, 46, 745—751 (1972).
з Nimni M., Deshmukh K., Science, 181, 751—752 (1973).
и McCullagh К. A., Balian G., Nature (London), 258, 73—75 (1975).