Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Синтез полисахаридов
Липидные переносчики
Кластер углеводных остатков специфической структуры составляет повторяющийся элемент структуры О-антигена сальмонеллы (рис. 5-11). Вспомним, что этот О-антиген прикреплен к сложному липополисахариду. По всей вероятности, и этот липополисахарид, и О-антиген синтезируются в бактериальной клетке ферментами, связанными с цитоплазматической мембраной [13, 14]. Полностью сформированная липополисахаридная структура перемещается от внутренней мембраны бактериальной клетки к наружной. Исследование синтеза липополисахаридного «ядра» («core») еще только начинается, тогда как биосинтез О-антигена изучен относительно полно; мы приводим схему процесса на рис. 12-3. Отличительная особенность этого пути биосинтеза заключается в его зависимости от специального полипренилового спирта уидекапренола (бактопренола). Это С55-соединение, содержащее две транс-двойные связи и 9 цис-двойных связей, относится к семейству изопреноидных липидов, которые имеются у всех живых существ и участвуют в качестве переносчиков в процессах биосинтеза, протекающих на клеточных мембранах (или в них).
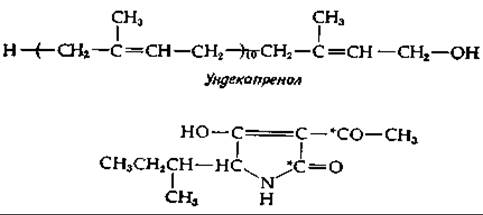
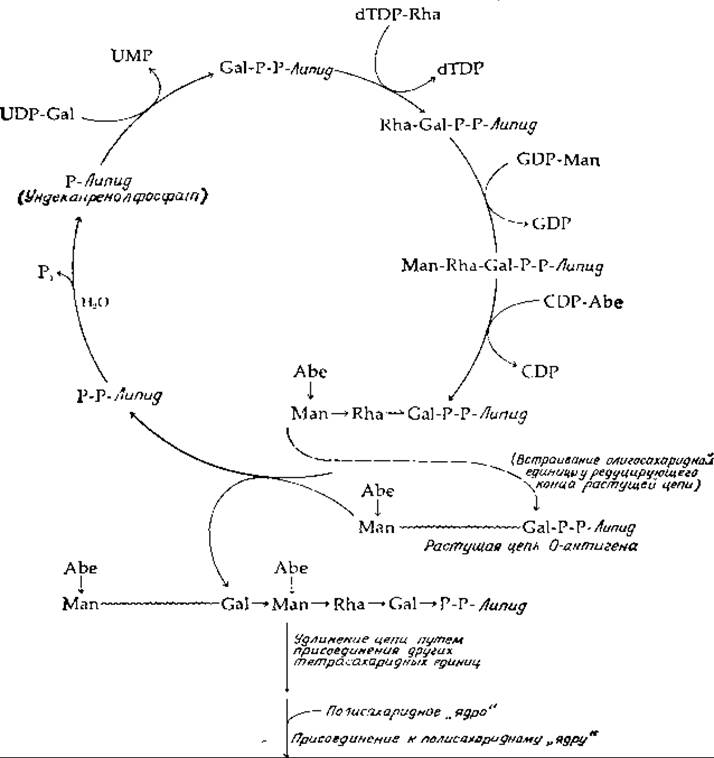
РИС. 12-3. Биосинтез полисахарида О-антигена у Salmonella typhimurium.
Гомологичный ряд родственных соединений — долихолов — содержит 16—20 пренильных остатков, из которых концевой, несущий ОН-группу, полностью насыщен [15]. Подобно ундекапренолу [15а], эти соединения образуют фосфорные эфиры. При этом фосфатная группа образованного эфира, по-видимому, выступает в цитоплазму, тогда как липидная цепь прочно закреплена в мембране. Конечно, эта картина не полна. Специфическая геометрия полипрениловых цепей свидетельствует о том, что они выполняют какую-то более сложную структурную и механическую функцию, которая нам еще не известна.
При синтезе О-антигенов ундекапренилфосфат (на рис. 12-3 сокращенно обозначенный Р-липид) вступает в реакцию с UDP-галактозой; при этом происходит перенос фосфогалактозильного остатка на липидный переносчик. Затем путем последовательных реакций переносов, катализируемых еще тремя трансферазами, образуется олигосахаридный остаток — повторяющаяся единица структуры О-антигена. В случае антигена, изображенного на рис. 12-3, один фермент переносит остаток рамнозы, второй — маннозы и третий — абеквозы от соответствующих нуклеотидсахаров. Далее вся растущая цепь О-антигена, прикрепленная ко второй молекуле ундекапренилдифосфата, присоединяется к хвосту уже собранного олигосахаридного остатка на другой молекуле ундекапренола, как показано на рис. 12-3. Таким образом, олигосахарид встраивается в растущую цепь со стороны ее восстанавливающего конца. Удлинение цепи продолжается путем переноса всей цепи на очередную тетрасахаридную единицу. При каждом акте присоединения олигосахаридной единицы происходит высвобождение ундекапренилдифосфата, от которого далее под действием фосфатазы отщепляется конечная фосфорильная группа и образуется исходный переносчик — ундекапренил(моно) фосфат. Наконец, когда синтезируемый О-антиген достигает достаточной длины, он прикрепляется к липополисахаридному «ядру» структуры.
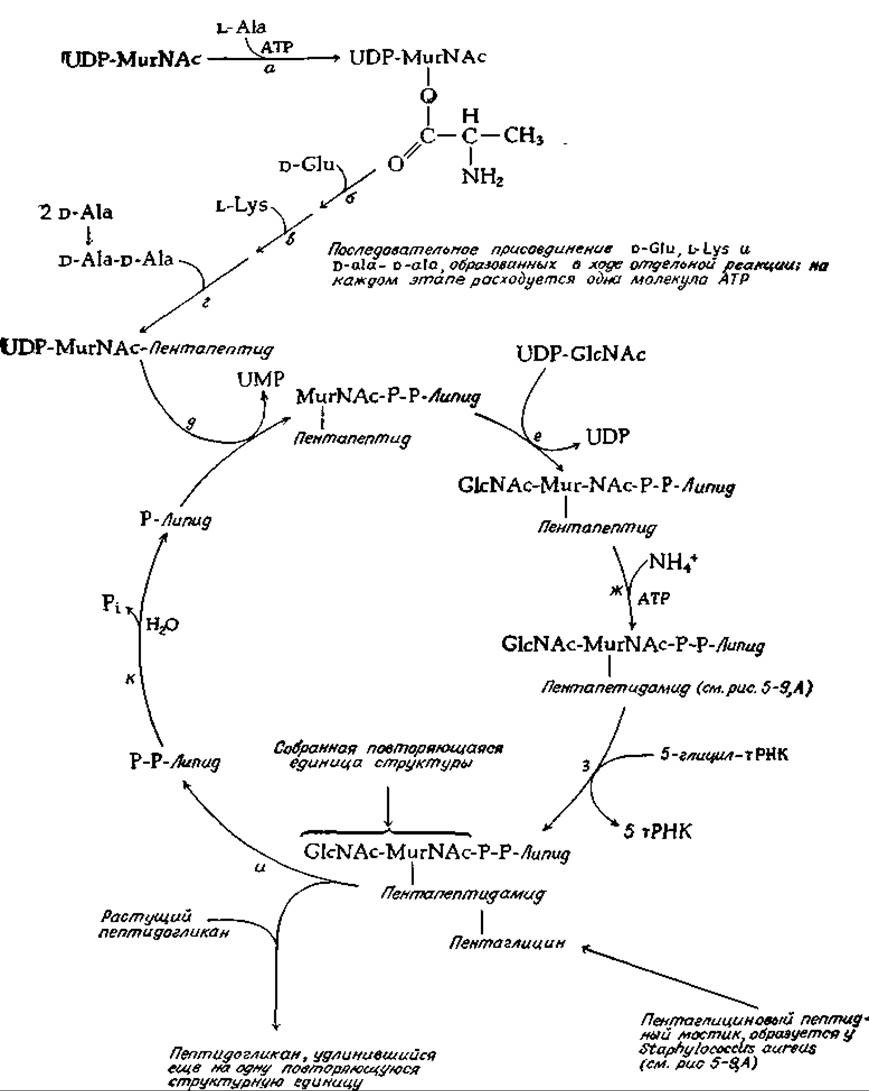
РИС. 12-4. Биосинтез пептидогликана у Staphylococcus aureus. Структура пептидогликана приведена на рис. 5-9, Л.
От ундекапренилфосфата зависит также другой биосинтетический цикл (рис. 12-4), а именно образование пептидогликанов клеточных стенок бактерий (рис. 5-9). Первым этапом этого процесса являете» синтез UDP-N-ацетилмурамовой кислоты согласно уравнению (12-5). Далее L-аланин присоединяется к ОН-группе лактильной единицы мурамовой кислоты в ходе типичной ATP-зависимой реакции (рис. 12-4, реакция а). Затем последовательно протекают ATP-зависимые реакции присоединения D-глутаминовой кислоты, L-лизина и D-аланил-О-аланина. Собранная таким путем полная структура переносится на ундекапренилфосфат (реакция (3). Далее под действием особой трансферазы присоединяется N-ацетилглюкозамин (реакция е), и в некоторых случаях свободная а-карбоксильная группа остатка глутаминовой кислоты связывает аммоний-ион; последний процесс протекает за счет энергии фосфатной связи АТР (реакция ж). Затем (реакция з) последовательно добавляются пять глицильных единиц, донором которых в каждом случае служит глицил-тРНК. Собранная повторяющаяся структура вместе с присоединенной пептидной цепью, необходимой для образования поперечных связей (дополнение 7-Г), переносится затем на растущую цепь (реакция и). Опять-таки, как в случае синтеза декстранов и О-антигена сальмонеллы, рост цепи идет с восстанавливающего конца (по механизму встраивания). При этом высвобождается полипренилдифосфат, и циклический процесс завершается действием фосфатазы (реакция к).
Несколько иную роль полипрениловый переносчик играет в синтезе маннана—полисахарида дрожжей. В составе основной цепи маннана углеводные остатки связаны а-1,6-связями, но имеются также короткие (состоящие из 1—3 остатков маннозы) боковые цепи, присоединенные через а-1,3- и а-1,2-связи. При синтезе маннана, по-видимому, в клетках дрожжей происходит перенос маннозильных единиц от GDP-маннозы на фосфорные эфиры долихолов, содержащих 14—18 пренильных остатков [16]. Липидный переносчик переносит остатки маннозы на растущую цепь маннана. Имеются многочисленные данные о наличии аналогичного механизма переноса маннозильных и N-ацетилглюкозильных единиц на гликопротеиды в животных тканях [17—19]. Было высказано предположение [19], что при этом образуются промежуточные соединения со структурой (а-Маn)4-(1—>4)-ß-Man-(1—>4)-GlcNac-(1—>4)-GlcNac-P-P-долихол. Участие полипрениловых спиртов в синтезе протеогликанов не доказано (разд. В 1), но весьма вероятно, что они функционируют в качестве переносчиков при сборке олигосахаридных единиц (как на рис. 12-3) гликопротеидов [19а]. Синтезируемые олигосахариды присоединяются к аминокислотам боковых цепей белков с образованием гликопротеидов, которые в дальнейшем либо секретируются клетками, либо включаются в состав плазматической мембраны.