Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции нуклеофильного замещения (реакция типа 1)
Гликогенфосфорилаза
Многие фосфорилазы ведут себя довольно загадочно. Например, мышечная гликогенфосфорилаза, катализирующая превращение гликогена (расщепление а-гликозидных связей) в a-D-глюкозо-1-фосфат, не обнаруживает ни способности катализировать парциальные реакции обмена, ни инверсии конфигурации, как этого можно было бы ожидать в случае реакции одноактного нуклеофильного замещения. Аналогичным образом при инкубировании фермента с глюкозо-1-фосфатом и арсенатом не происходит арсенолиза [18]. Возможно, это объясняется тем, что фермент не проявляет активности, пока не будут связаны оба субстрата. А это значит, что для функционирования активного центра фермента необходимо, чтобы между конформацией фермента и структурой двух субстратов установилось строгое соответствие, т. е. что активная конформация ферментного белка стабилизируется в присутствии субстратов.
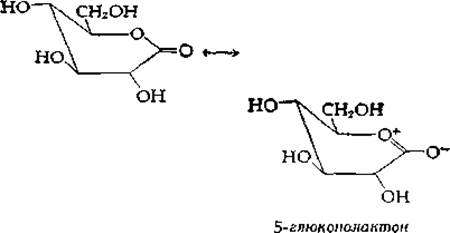
Для объяснения действия гликогенфосфорилазы предложен механизм с участием карбоний-иона. В основе этого предположения отчасти лежат данные о сильном ингибировании фермента 5-глюконолактоном (соединением, имеющим конформацию «полукресла») [18, 19]:
Гликогенфосфорилаза — необычный гликолитический фермент. Он содержит связанный кофермент — пиридоксаль-5'-фосфат (гл. 8, разд. Д,3), роль которого в механизме действия фермента пока не установлена [18, 20].