Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции нуклеофильного замещения (реакция типа 1)
Другие ферменты, действующие на гликозиды
Широко распространенные а-амилазы [21, 22] являются эндогликозидами, гидролизующими полисахаридные цепи крахмала путем атак в случайных точках, расположенных далеко от концов полисахаридной цепи, с образованием коротких полисахаридных цепей (декстринов) и простых сахаров. Реакция протекает с сохранением конфигурации, причем образующиеся восстанавливающие группы находятся в а-аномерных формах. а-Амилазы обнаружены как у растений, так и у животных. Например, один высокоактивный фермент этого класса найден в слюне человека1), а другой вырабатывается поджелудочной железой. По-видимому, всем а-амилазам совершенно необходимы хлорид-ионы, действующие как активаторы. Однако, какова их роль в механизме действия фермента, до сих пор не ясно.
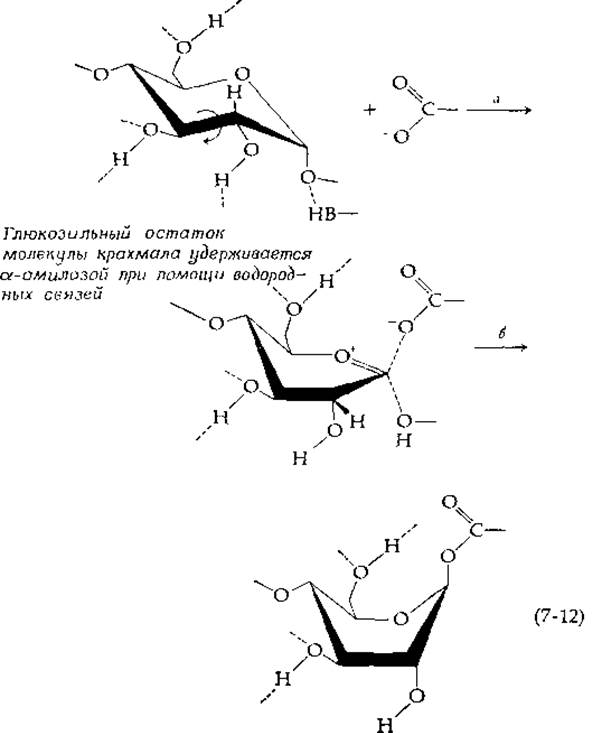
Изучение характера действия а-амилаз позволяет обнаружить многие детали возможного типа связывания субстрата, а также выяснить возможные механизмы ферментативного действия [22, 23]. У фермента из поджелудочной железы свиньи область связывания субстрата имеет, по-видимому, пять подцентров, каждый из которых способен удерживать один остаток глюкозы. Расщепление цепи происходит по связи между остатками, связанными со вторым и третьим подцентрами (пронумерованными от восстанавливающего конца молекулы субстрата). При использовании различных О-замещенных субстратов было найдено, что наличие оксиэтильных групп во многих частях молекулы субстрата не мешает проявлению каталитического действия фермента. Однако при использовании субстратов, содержащих оксиэтильную группу при С-2, С-3 или С-6 того остатка глюкозы, у которого происходит замещение, ферментативное действие блокируется. Лактон мальтобионовой кислоты (4-глюкозильное производное 5-глюконолактона) является мощным ингибитором конкурентного типа. Следовательно, можно думать, что субстрат этого фермента имеет конформацию полукреcла в переходном состоянии или в состоянии, близком к переходному. Френч и др. [23] высказали предположение, что фермент прочно удерживает глюкозильный остаток за счет образования водородных связей с гидроксильными группами при С-3 и С-6, а затем вызывает вращение вокруг связи С-2—С-3 путем точного захвата и смещения гидроксильнЬй группы при С-2 [стадия а в уравнении (7-12)]. Таким образом, конформационные изменения в молекуле фермента могут быть связаны с превращением структуры субстрата в переходное состояние. Так же как и в случае лизоцима, наряду со стабилизацией карбоний-иона соседним карбоксилат-ионом предполагается протонирование мостикового атома кислорода (возможно, имидазольной группой). Еще одна возможность заключается в том, что карбоксилат-ион образует настоящую связь с С-1 [как в уравнении (7-6)], и в результате этот процесс завершается конформационной перестройкой в кольце сахара, что приводит к образованию высокоэнергетической переходной конформации формы лодки [22] [стадия б в уравнении (7-12)].
1) Однако у некоторых вполне нормальных индивидуумов этот фермент полностью отсутствует.
Изучение амилаз важно для понимания еще одного аспекта действия ферментов. Вопреки общепринятому представлению, что место атаки биополимеров эндолитическими ферментами носит случайный характер, было показано, что в амилазной реакции после осуществления первого акта каталитической реакции один из полисахаридных продуктов часто остается на ферменте в связанном состоянии. Молекула полисахарида просто «перескальзывает», пока вновь не займет все подцентры субстратсвязывающего центра и не начнется вторая «атака». а-Амилаза из поджелудочной железы свиньи проводит в среднем семь каталитических актов за то время, пока она находится в комплексе с амилозой [24]. Возникает важный вопрос, существует ли специальный механизм, при помощи которого фермент обусловливает перемещение субстрата, или отщепляющийся продукт просто диффундирует на короткое расстояние, находясь в ячейке растворителя. Последнее объяснение является, по-видимому, более вероятным [24]. Концепция многократной атаки, вытекающая из этих исследований, может сыграть важную роль в понимании таких биосинтетических механизмов, как репликация и транскрипция ДНК (гл. 15).
ß-Амилазы, типичные ферменты растений, действуют по экзо-типу, отщепляя от концов цепи одновременно по две сахарные единицы в виде мальтозы. Исходная a-связь инвертируется, приводя к образованию ß-мальтозы. Таким образом, возможно либо прямое одноактное замещение водой, либо механизм с участием карбоний-иона [25].
Известно много других гликозидаз. Некоторые из них относятся к числу гидролитических ферментов, предназначенных для отщепления определенных сахарных колец от молекул субстратов. Многие биосинтетические гликозилтраисферазы переносят гликозильные звенья с одной молекулы на другую (гл. 5, разд. Б,1, В,1 и Г, 1; гл. 12, разд. В, 1).