Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции замещения у карбонильных групп
Реакции типа 1.Б (табл. 7-1) заключаются в нуклеофильном замещении группы Y, присоединенной к углероду карбонильной группы. Субстрат может представлять собой эфир (Y = OR), тиоэфир (Y=SR) или амид (Y=NHR), а ферментативная реакция — гидролиз (когда В- — это ОН-, образующийся из воды) или трансацилирование (когда В- — это анион спирта, тиола или амина). Процессы трансацилирования играют исключительно важную роль в биосинтезе, однако наиболее интенсивно изучены ферменты, катализирующие реакции гидролиза.
Карбонильная группа
![]()
сильно поляризована, и значительный вклад в ее структуру вносит резонансная форма
![]()
Благодаря этому основание легко атакует электрофильный атом углерода Хотя реакционноспособность карбонильной группы в амидах и сложных эфирах значительно понижена стабилизацией этих групп вследствие резонанса, атомы углерода карбонильной группы этих соединений все же сохраняют электрофильный характер и могут присоединять основные группы. Так, при катализируемом основаниями гидролизе эфиров гидроксильный ион может присоединяться к карбонильной группе с образованием насыщенного «тетраэдрического» промежуточного соединения;
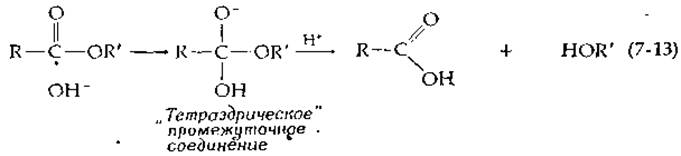
Подобные промежуточные соединения могут образовываться при действии многих ферментов, катализирующих реакции типа 1.Б (табл. 7-1). Однако для удобства классификации эти реакции можно рассматривать как простые реакции замещения при углеродном атоме, учитывая при этом, что в некоторых случаях могут образовываться насыщенные промежуточные соединения.
К числу гидролиз относятся ацетилхолинэстераза нервных клеток (дополнение 7-Б) и большое число пищеварительных ферментов. Среди последних наиболее изучены протеиназы и пептидазы. Пепсин, трипсин, химотрипсин и карбоксипептидаза являются высокоэффективными катализаторами расщепления белков. Все они секретируются в виде неактивных проферментов (гл. 6, разд. Ж,2), или иначе, зимогенов [26]. После синтеза на рибосомах эндоплазматического ретикулума особых секреторных клеток проферменты «упаковываются» в виде зимогеновых гранул, которые затем мигрируют к поверхности клетки и секретируются в окружающую среду. Пепсиноген является компонентом желудочного сока, в то время как химотрипсиноген, трипсиноген и другие панкреатические проферменты через проток поджелудочной железы попадают в тонкую кишку. Достигнув места своего действия, зимогены превращаются в активные ферменты под действием молекулы другого фермента, отсекающей от предшественника фрагмент (иногда довольно большой) полипептидной цепи [25].
Дополнение 7-Б
Инсектициды
В настоящее время используется более 200 органических инсектицидов, предназначенных для того, чтобы уничтожать насекомых, не нанося существенного вреда людям и животныма-г. Действие многих из этих соединений состоит в ингибировании дыхания клеток; другие «разобщают» синтез АТР и перенос электронов. Хлорированные углеводороды, такие, как ДДТ, действуют на нервную систему, причем механизм этого действия до сих пор еще не установлен. Один из крупнейших классов органических инсектицидов действует на специфический фермент нервной системы — ацетилхолинэстеразу. Нейромедиатор ацетилхолин выделяется из нервных окончаний в области многих синапсов (гл. 16). Ацетилхолин (обладающий большой токсичностью, когда он находится в избыточных количествах) должен быстро разрушаться, в противном случае синапс не будет готов к передаче следующею импульса:
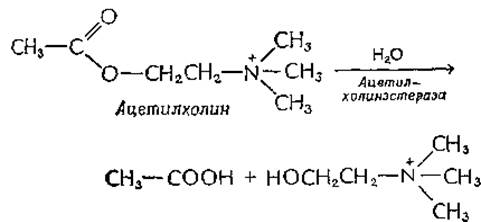
Как и в случае химотрипсина, в активном центре ацетилхолинэстеразы содержится остаток серина, который реагирует с фосфорорганическими соединениями (например, с динзопропилфторфосфатом; разд. Г,1,а).
В 30-х годах была установлена исключительно высокая токсичность эфиров пирофосфата и диалкилфторфосфатов; эти данные легли в основу создания в Германии и Англии инсектицидов и так называемых нервных газов. К числу наиболее известных подобных соединений относится сам диизопропилфторфосфат (ДФФ), LD50 (доза, летальная для 50% подопытных животных), которого при внутривенном введении составляет всего 0,5 мкг на 1 кг веса животного. Это крайне опасное соединение может вызывать быструю смерть и при всасывании через кожу. Обнаружено множество фосфорорганических соединений и других ингибиторов ацетилхолин-эстеразы, обладающих избирательной токсичностью по отношению к насекомым. К ним, например, относятся
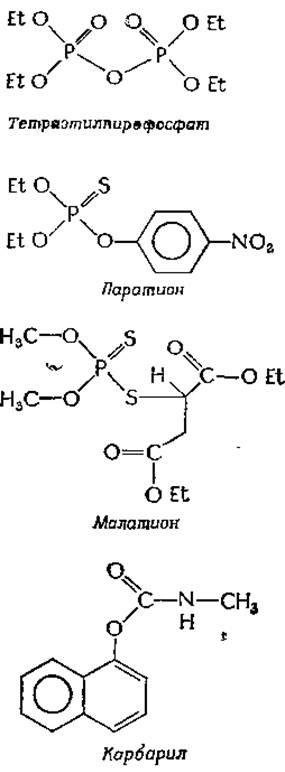
Характерный для фосфатной группы в пирофосфатной связи высокий потенциал переноса группы, благодаря которому АТР играет в клетках столь важную роль, обусловливает также способность тетраэтилпирофосфата (ТЭПФ) фосфорилировать активные центры ацетилхолинэстераз. Хотя ТЭПФ — соединение очень токсичное, оно быстро гидролизуется, и уже через несколько часов после применения все токсичные группы разрушаются.
Два из наиболее широко применяемых в настоящее время инсектицидов — это паратион и малатион. Эти соединения гораздо менее токсичны, чем ДФФ или ТЭПФ. Их эффективность в качестве инсектицидов приобретается после биоактивации, при которой происходит превращение связи P=S в связь Р=О:
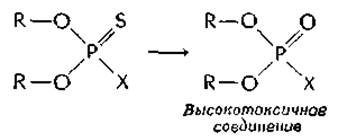
Реакция десульфирования протекает при участии микросомных оксидаз печени, причем сера в конце концов окисляется до сульфатад.
Реакционноспособность паратиоиа по отношению к холинэстеразам обеспечивается высоким потенциалом переноса групп, сообщаемым присутствием отличной уходящей группы — n-нитрофенолят-аниона (см. также разд. Г,1,6). Если связь Р—О этой группы гидролизуется раньше, чем произойдет реакция десульфирования, то фосфорсодержащее соединение становится безвредным. Таким образом, проблема создания эффективных инсектицидов включает поиск таких соединений, которые быстро активируются в организме насекомых, но легко разрушаются в организме высших животных. Важное значение при этом имеют и такие факторы, как способность соединения к проникновению через кутикулу насекомых и скорость его выведения из организма.
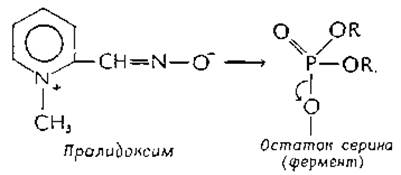
Фосфорилированные эстеразы, образующиеся при действии фосфорорганических ингибиторов, весьма стабильны, однако найдены противоядия, способные обращать ингибирование. Очень эффективен в этом отношении оксим 2-формил- 1-метилпиридиний-иона (пралидоксим)е. Считается, что положительный заряд этого соединения способствует его связыванию в том центре, который обычно занимает четвертичный атом азота ацетилхолина, и вытеснению диалкилфосфатной группы:
Карбарил, широко используемый метилкарбамат, служит псевдосубстратом ацетилхолинэстеразы, который реагирует в 105—106 раз медленнее, чем обычные субстраты. Образующийся карбамоилированный фермент не столь стабилен, как фосфорилированные ферменты, и поэтому ингибирование под действием карбарила обратимо.
а Casida J. Е., (1973). Annu. Rev. Biochem., 42, 259—278.
б Heath D. F., (1961). Organophosphorus poisons. Pergamon, Oxford.
в Schrader G., (1963). Die Entwicklung neuer insektizider Phosphorsäure- Ester. Verlag Chemie, Weinheim.
г Bull W. H. O., 44, 1—470 (1971).
д Nakatsugawa T., Tolman N. M., Dahm P. A. (1961). Biochem Pharmacol., 18, 1103—1114.
e Wilson I. B., Ginsburg S. (1955). Biochim. biophys. acta, 18, 168—170.