Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Репликация ДНК
Ферменты синтеза ДНК
После того как была идентифицирована ДНК-полимераза Г (разд. А, 3, а), считалось, что обнаружен основной фермент, обеспечивающий элонгацию цепи при синтезе ДНК. Однако открытие amber-мутанта Е. coli, у которого отсутствовал ген, кодирующий полимеразу I (ген polA; рис. 15-1), а синтез ДНК тем не менее протекал нормально, стимулировало интенсивный поиск новых ДНК-полимераз. Были обнаружены два других фермента — ДНК-полимераза II (ген polB) и ДНК-полимераза III, содержание которых не превышало 25% содержания ДНК-полимеразы I [195, 196]. По своим свойствам оба фермента напоминали ДНК-полимеразу I, однако в некоторых отношениях эти ферменты значительно различались.
Одно из свойств ДЙК-полимеразы I, о котором мы не упоминали ранее, состоит в том, что фермент не только катализирует рост цепей ДНК с 3-конца цепи-затравки, но и вызывает также протекающее в 10 раз медленнее гидролитическое отщепление нуклеотидов с 3-конца. Кроме того, тот же фермент может катализировать гидролитическое отщепление нуклеотидов с 5'-конца цепей ДНК. Было показано, что описанные активности локализуются в разных частях одной и той же белковой молекулы, как будто ДНК-полимераза I представляет собой продукт двух слившихся генов [197]. В отличие от ДНК-полимеразы I ДНК-полимеразы II и III не катализируют гидролитическое отщепление нуклеотидов с 5'-конца.
Предполагают, что 3'—5'-экзонуклеазное действие позволяет ДНК-полимеразе I играть роль как бы «корректора». Эта полимераза действует на З'-конце растущей цепи ДНК. Согласно предположению о роли ДНК-полимеразы I как корректора, прежде чем передвинуться в следующее положение1), фермент проверяет правильность образования предыдущей пары оснований. Если предыдущая пара сформирована неправильно, то фермент работает как экзонуклеаза, удаляя неправильно присоединенный нуклеотид, что позволяет полимеразе присоединить затем нужный нуклеотид. Таким образом, каждая пара оснований проверяется дважды — первый раз до полимеризации и второй раз — после полимеризации. Схематически этот процесс показан на рис. 15-30. На рисунке видно, каким образом может реализоваться 3'—5'-экзонуклеазная активность после того, как фермент достигнет конца промежутка.
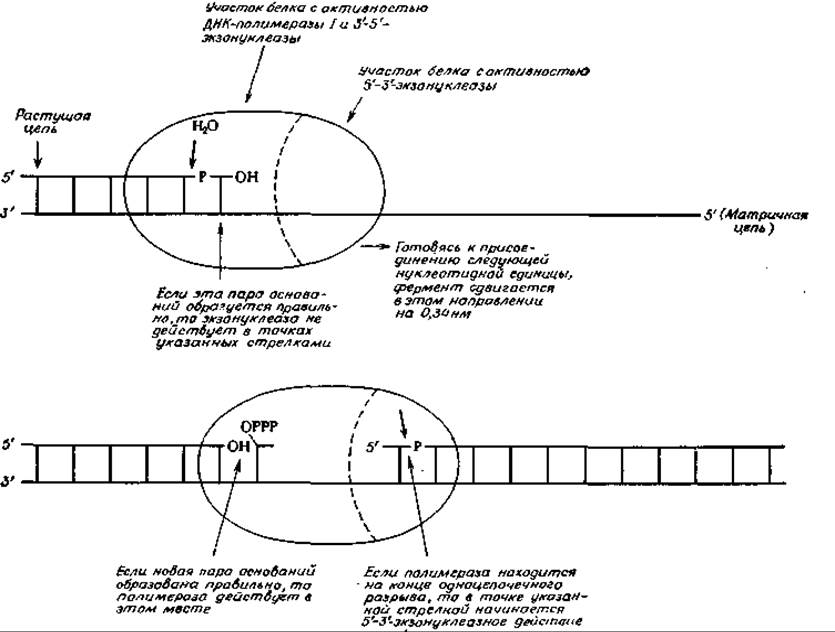
РИС. 15-30. Схематический рисунок, показывающий три типа ферментативной активности ДНК-полимеразы I. Верхний рисунок иллюстрирует 3'-5'-экзонуклеазную или «корректирующую» активность фермента. Хотя на рисунке показано, что фермент передвигается на одно положение вперед до того, как произойдет следующий этап, на самом деле момент, когда происходит передвижение, не установлен. Нижний рисунок иллюстрирует реакцию полимеризации и 5'-3'-экзонуклеазное действие.
1) Неизвестно, когда полимераза проверяет правильность спаривания оснований, до или после передвижения к следующему месту полимеризации. Точно установлено лишь то, что фермент удаляет с 3'-конца любой неправильно спаренный нуклеотид.
Важную информацию удалось получить при изучении процесса репликации при помощи генетических методов [196, 198]. Была получена серия температурочувствительных мутантов Е, coli, не способных к синтезу ДНК. С их помощью в разных точках хромосомной карты удалось идентифицировать гены dnaA, В, С, D, Е, F и G. Продукты генов А и, возможно, С, необходимы для инициации репликации, но не нужны для элонгации. Гены В, D, Е и G участвуют в элонгации. Гены С и D расположены на карте очень близко друг от друга (89 мин). Сейчас есть основания считать, что они представляют собой один ген. Возможно, что этот ген кодирует синтез бифункционального белка, способного катализировать как процесс инициации, так и процесс элонгации. Продукт гена F был идентифицирован как рибонуклеотидредуктаза [уравнение (14-50)]. Итак, остаются продукты генов В, D, Е и G, играющие, по-видимому, важную роль в элонгации. Ни один из этих генов не детерминирует синтеза ДНК-полимеразы I. Для ДНК-полимеразы III был идентифицирован ген dnaE. Таким образом, ключевая роль этой полимеразы подтверждается генетически. Однако эта полимераза сама по себе не способна реплицировать двухцепочечную ДНК; для ее функционирования необходимо наличие других белков.
Среди ДНК-полимераз эукариотических клеток различают а, ß- и у-формы, которые обнаруживаются в ядрах (a-форма была обнаружена и в цитоплазме), а также митохондриальный (mt) фермент [199].
Если тот факт, что репликация ДНК У Е. coli начинается процессом специфической инициации, за которым следует элонгация вдоль хромосомы в двух направлениях, установлен вполне надежно, то вопросы, касающиеся терминирования процесса репликации, изучены значительно хуже. В результате ряда экспериментов было установлено, что терминация каким-то образом запускает синтез специфической мРНК и белка, необходимых для деления клетки [200]. Таким образом, клеточный цикл состоит как бы из серий последовательно протекающих событий, каждое из которых «включает» следующее событие.