Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Рестрикция и модификация ДНК
Рестриктирующие эндонуклеазы
Между вирусами и бактериями беспрестанно продолжается борьба, причем как атакующий фаг, так и бактерия-хозяин пользуются разнообразными орудиями защиты и нападения. Так, например, после вторжения в бактериальную клетку многие вирусы не только выключают синтез клеточной ДНК, «о и разрушают ее благодаря наличию специфических ферментов (как эндонуклеаз, так и экзонуклеаз), синтез которых закодирован в геноме вируса [211—214]. С другой стороны, бактерии-хозяева используют имеющееся у них оружие и часто с его помощью модифицируют ДНК вируса, защищаясь таким образом от его разрушающего действия1). Так, ферменты, детерминируемые Т-четными фагами, превращают цитидинмонофосфат в 5'-окснметил-СТР, причем модифицированные нуклеотиды обнаруживаются в вирусных ДНК [212]. Более того, вновь образованная гидроксильная группа может быть в различной степени глюкозилирована (гл. 2, разд. Г, 8).
1) Любопытно, что бактерии развиваются таким образом, чтобы не мешать росту фагов. Многие мутанты, однако (grov), блокируют рост фагов λ, Т3, Т4, Т7 и т. д., но сами растут при этом нормально. Тот факт, что такие бактерии не превращаются з дикий тип, указывает, какое важное значение для бактерии имеет их сосуществование с фагом.
Бактерии часто переваривают и разрушают ДНК вторгшихся в них вирусов или ДНК, попавшую в клетку при спаривании с бактерией несовместимого штамма. В результате исследований этого интересного явления, получившего название рестрикция, было обнаружено, что ДНК вирусов, способных к репликации лишь в определенных клетках- хозяевах, в специфических местах каким-то образом маркирована. Причем во многих случаях метками являются метальные группы. Оказалось, что соответствующим образом метилированная ДНК не расщепляется бактерией, тогда как неметилированная ДНК расщепляется высокоспецифичной эндонуклеазой именно в тех местах, в которых обычно происходит метилирование. У каждого вида бактерий (а часто даже и у отдельных штаммов в пределах данного вида) имеются свои собственные рестриктирующие ферменты. Рестриктирующие ферменты обладают очень высокой степенью специфичности и часто разрезают ДНК всего лишь в нескольких точках (или рядом с ними), для которых характерна уникальная последовательность оснований. В настоящее время удалось выделить около 45 таких ферментов с разной специфичностью.
Рестриктирующие эндонуклеазы, детерминируемые хромосомой Е. coli, — это крупные белки с мол. весом порядка 300 000—400 000, состоящие из полипептидных цепей трех типов. Они явно связываются со специфическими участками и неспецифически разрушают прилегающие к ним участки. Для их действия необходимо наличие АТР, ионов Mg2+ и S-аденозилметионина. Уникальная особенность этих белков состоит в способности вызывать гидролиз необычно больших количеств АТР [215]. Значение всех этих свойств рестриктирующих ферментов остается до сих пор неясным. Второй класс рестриктирующих ферментов состоит из относительно небольших мономерных или димерных белков с мол. весом 50 000—100 000. Местом атаки этих ферментов служат, как правило, нуклеотидные последовательности с локальной симметрией второго порядка [217]. Так, например, для двух рестриктирующих эндонуклеаз, детерминируемых ДНК плазмиды R-фактора Е. coli, и рестриктирующего фермента Hemophilus influenzae были идентифицированы следующие участки расщепления (в приведенной ниже схеме стрелками показаны места расщепления, звездочками — места метилирования, а точками — локальная ось симметрии второго порядка):
R-фактор E. coli (Eco RI)
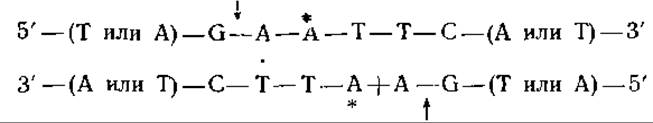
R-фактор E. coli (Eco RII)
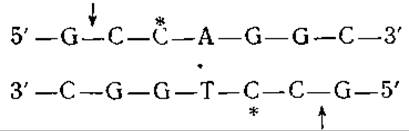
H. influenzae (Hind III)
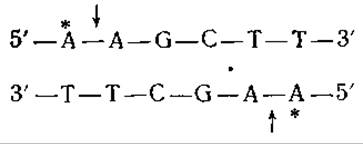
Во многих случаях рестриктирующие ферменты образуют разрывы в каждой из двух цепей в местах, расположенных симметрично относительно оси симметрии второго порядка. Этого и следовало ожидать в случае, если димерный фермент связывается с большой или с малой бороздкой двойной спирали и каждый активный центр взаимодействует с одной из полинуклеотидных цепей.