Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Свет в биологии
Фотохимия
Химическое равновесие в возбужденном состоянии
Поскольку при переходе в возбужденные состояния (синглетные и триплетные) энергия молекул повышается, последние приобретают химические свойства, которых не было у невозбужденных молекул [67, 67а]. Изменения значений рKа функциональных групп при переходе в возбужденное состояние могут приводить к диссоциации протонов или к их присоединению. Диссоциация на ионы или радикалы иногда сопровождается разрывом связей. Могут протекать реакции фотоприсоединения и фотоотщепления, а также изомеризация молекул, играющая важную роль в функционировании зрительных рецепторов. Возбужденные молекулы могут стать сильными окислительными агентами, способными принимать атомы водорода или электроны от других молекул. Примером такого рода служит фотоокисление ЭДТА рибофлавином (подвергающимся фотовосстановлению, как показано на рис. 8-15). Более важным с точки зрения биологии процессом является фотосинтез, в ходе которого возбужденные молекулы хлорофилла осуществляют фотовосстановление других молекул, временно оказываясь при этом в окисленном состоянии. К сожалению, ценность исследования фотохимических реакций сильно снижается возможностью протекания множества параллельных реакций, зачастую приводящих к образованию огромного количества разных фотохимических продуктов (достаточно взглянуть на тонкослойную хроматограмму продуктов распада рибофлавина, рис. 2-34).
При облучении пиридоксамина, который находится в форме биполярного циклического иона [схема 18-2711 и имеет полосу поглощения ![]() максимум флуоресценции наблюдается при
максимум флуоресценции наблюдается при ![]() Если же облучают основный пиридоксамин, находя щийся в форме циклического аниона и имеющий полосу поглощения С
Если же облучают основный пиридоксамин, находя щийся в форме циклического аниона и имеющий полосу поглощения С ![]() то максимум флуоресценции наблюдается при 27 000 см-1, т. е. сдвиг от максимума поглощения снова составляет ~5500 см-1. Однако, если то же соединение поместить в кислую среду, в которой
то максимум флуоресценции наблюдается при 27 000 см-1, т. е. сдвиг от максимума поглощения снова составляет ~5500 см-1. Однако, если то же соединение поместить в кислую среду, в которой ![]() максимум люминесценции опять наблюдается при 25 000 см-1 (т. е. его положение совпадает с таковым для нейтральной биполярной ионной формы) и, следовательно, сдвинут от максимума поглощения на 9000 см-1 [68, 69]. Это явление, наблюдаемое для большинства фенолов, было объяснено быстрой диссоциацией протона фенольной группы, находящейся в фотовозбужденном состоянии. Таким образом, возбужденный пиридоксаминовый катион в кислой среде быстро превращается в биполярный ион. Другими словами, фенольная группа в возбужденном состоянии становится более кислой, чем в основном.
максимум люминесценции опять наблюдается при 25 000 см-1 (т. е. его положение совпадает с таковым для нейтральной биполярной ионной формы) и, следовательно, сдвинут от максимума поглощения на 9000 см-1 [68, 69]. Это явление, наблюдаемое для большинства фенолов, было объяснено быстрой диссоциацией протона фенольной группы, находящейся в фотовозбужденном состоянии. Таким образом, возбужденный пиридоксаминовый катион в кислой среде быстро превращается в биполярный ион. Другими словами, фенольная группа в возбужденном состоянии становится более кислой, чем в основном.
Прямую информацию о значениях рКа группы в возбужденном состоянии может дать исследование зависимости интенсивности флуоресценции от pH. Для оценки рКа фенолов в возбужденном состоянии используется также более косвенная методика (предложенная Фёрстером). Пусть E1 — энергия 0—0-перехода для недиссоциированной формы (определяемая лучше всего как среднее между наблюдаемыми энергиями перехода в спектрах поглощения и флуоресценции), а Е2 — энергия 0—0-перехода для диссоциированной формы (анионной в случае фенолов); далее, пусть ∆Н и ∆Н* — энтальпия диссоциации соответственно в основном и возбужденном состояниях. Отсюда сразу следует, что
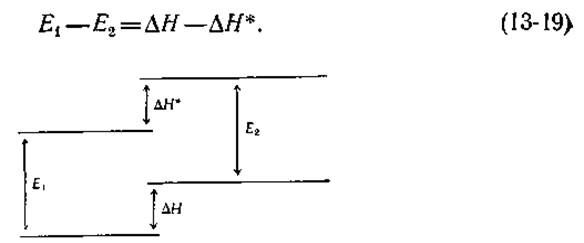
Если принять, что изменение энтропии для реакций в основном и возбужденном состояниях одинаково, то мы получим следующие соотношения:
![]()
или
![]()
Из уравнения (13-21) следует, что сдвиг спектра поглощения основной формы на 1000 см-1 в сторону более низких значений волнового числа, относительно спектра кислой формы соответствует уменьшению рКа для диссоциации кислой формы на 2,1 единицы. Хотя положение 0—0- полосы лучше определять одновременно по спектрам поглощения и флуоресценции, часто снимают лишь спектры поглощения и положение 0—0-полосы определяют по положению максимума полосы поглощения. Так, для пиридоксамина сдвиг максимума поглощения от 34 000 см-1 в протонированной форме к 30 700 см-1 в диссоциированной форме предполагает, что рКа пиридоксамина, равное 3,4 в основном состоянии, при возбуждении уменьшится на 6,9 единицы, до значения —3,50.
В то время как фенолы и амины в синглетном возбужденном состоянии оказываются более кислыми; чем в основном, некоторые соединении (например, ароматические кетоны) в фотовозбужденном состоянии становятся более основными.
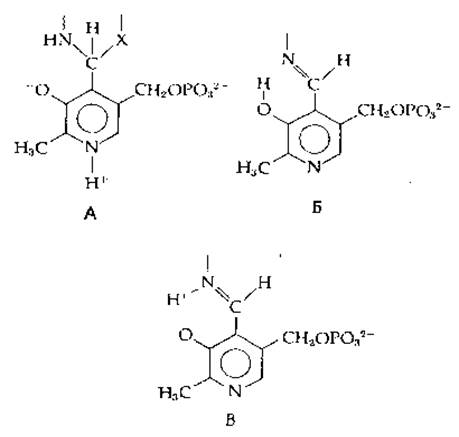
Наличие аномально большого сдвига спектра флуоресценции нашло весьма интересное применение в работе Джонсона и др. [70]. Поглощение пиридоксальфосфата в составе гликогенфосфорилазы при λ = 330 нм (30 300 см-1) может быть обусловлено либо образованием аддукта между одной из функциональных групп фермента и шиффовым основанием, образованным PLP и боковой цепью лизина (структура А), ибо образованием неионной циклической формы шиффова основания гидрофобном окружении (структура Б). Для структуры А положение спектра флуоресценции должно быть таким же, как и для пиридоксалинa. С другой стороны, в шиффовом основании такого типа, как в структуре Б, должно иметь место фотоиндуцированное перемещение протона (фототаутомеризация) с образованием соединения В, имеющего полосу поглощения с λmах = 430 нм (23 300 см-1) и флуоресцирующего при еще меньших длинах волн [52, 70]. Поскольку λmах флуоресценции равна 530 нм, был сделан вывод, что хромофор имеет структуру Б.
1) Согласно расчетам Бриджеса и др. [69], значение рК* составляет —4,25, тогда как из pH-зависимости флуоресценции найдено рК* ≈ —4,1.
Скорость диссоциации протона для молекул, находящихся в возбужденном состоянии, в настоящее время измеряют непосредственно с помощью наносекундной флуориметрии [71].