Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Рост, дифференцировка и химическая коммуникация клеток
Гормоны
Гормоны позвоночных
Основные гормоны позвоночных, известные в настоящее время, перечислены в табл. 16-1, где приведены также ссылки на те раздельные книги в которых рассматриваются отдельные гормоны. По химической структуре гормоны могут быть разделены на три группы: 1) белки и пептиды, 2) производные ароматических аминокислот, 3) стероиды и простагландини.
Гормоны гипофиза заслуживают специального упоминания. Гипофиз соединен с мозгом при помощи «ножки» (рис. 16-1); в гипофизе образуется по крайней мере 10 белковых и пептидных гормонов, которые регулируют активность других эндокринных (т. е. продуцирующих гормоны) желез в различных частях тела.
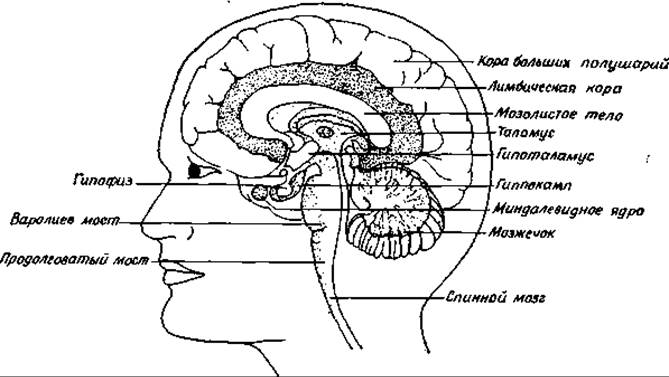
РИС. 16-1. Срединный сагиттальный разрез мозга человека (Pines Maya, Saturday Review Aug., 9, стр. 14, 1975).
Гипофиз состоит из нескольких частей. Как уже упоминалось, передняя доля гипофиза (аденогипофиз) выделяет гормоны в ответ на действие по крайней мере девяти нейрогормонов, называемых либеринами (факторами высвобождения, релизинг-факторами) [6, 7]. Либерины секретируются гипоталамусом в ничтожно малых количествах. Химическая структура нескольких либеринов была установлена лишь недавно. Как было показано на рис. 12-2, часть из них представляет собой модифицированные простые пептиды. Меланоцитстимулирующий гормон (меланотропин) средней доли гипофиза тоже высвобождается под действием определенного гипоталамического фактора — меланолиберина.
В гипоталамусе синтезируется также ряд факторов, подавляющих выделение гормонов [8]. Один из них — соматостатин — ингибирует высвобождение соматотропина, снижая таким образом эффект самотолиберина. Соматостатин вызывает большой интерес еще и по другой причине.
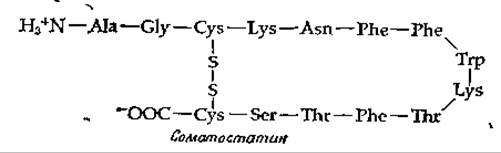
Дело в том, что он действует не только на гипофиз, но и на поджелудочную железу, где подавляет выделение инсулина и глюкагона. В результате происходит снижение содержания глюкозы в крови, что открывает новые подходы к лечению диабета (дополнение 11-В).
Таблица 16-1 Гормоны позвоночных
|
Тип, название и источник гормона |
Основное место приложения действия |
Где описан данный гормон |
|
А. Пептидные и белковые гормоны 1. Гипофиз а. Аденогипофиз (передняя доля) |
||
|
Соматотропин (гормон роста, ГР) |
Все ткани |
|
|
Кортикотропин (АКТГ, АСТН) |
Кора надпочечников, жировая ткань |
Рис. 2-2 Гл. 6. разд. Е,5 |
|
Тиреотропин (тиреотропный гормон, ТТГ) |
Щитовидная железа |
Гл. 14, разд. 3,5 |
|
Фоллитропин (фолликулостимулирующий гормон, ФСГ) |
Яичник, семенники |
Гл. 12, разд. И,3,г |
|
Лютропин (лютеинизирующий гормон, гормон, стимулирующий интерстициальные клетки, ИКСГ или ЛГ) |
То же |
Гл. 12, разд. И,3,г |
|
Пролактин (мамматропин) |
Молочные железы |
|
|
Липотропин |
Гл. 16, разд. А, 1 |
|
|
б. Нейрогипофиз (задняя доля) |
||
|
Окситоцин |
Матка, молочные железы |
Рис. 2-2 |
|
Вазопрессин (антидиуретический гормон) |
Почки, артерии |
Рис. 2-2 |
|
в. Средняя доля гипофиза |
||
|
Меланотропин |
Меланофоры |
|
|
2. Поджелудочная железа |
||
|
Инсулин |
Все клетки |
Гл. 4, разд. Г,7; гл. 5, |
|
разд. В,5; гл. 6, разд. Е,5; гл. 12, разд. Е,1 |
||
|
Глюкагон |
Печень, жировая ткань |
Гл. 6, разд. Е,5; гл. 11, разд. Е,5; гл. 12, разд. Е, 1 |
|
3. Яичник (желтое тело) |
||
|
Релаксин |
Связочный аппарат таза |
|
|
4. Щитовидная железа |
||
|
Кальцитонин (тиреокальцитонин) |
Кости, почки |
Дополнение 5-Д |
|
5. Паращитовидная железа |
||
|
Паратирин (паратгормон) |
То же |
Дополнение 5-Д; гл. |
|
12, разд. 3, и дополнение 12-Г; гл. 16, |
||
|
6. Почки |
разд. АД |
|
|
Эритропоэтин |
Костный мозг |
|
|
Ренин |
Корковый слой |
|
|
7. Пищеварительный тракт |
||
|
Гастрин |
Желудок |
|
|
Энтерогастрин |
» |
|
|
Холецистокинин |
Желчный пузырь |
|
|
Секретин |
Поджелудочная железа |
|
|
Панкреозимин |
То же |
|
|
Б. Гормоны — производные аминокислот |
||
|
1. Щитовидная железа |
||
|
Тироксин и тринодтиронин |
Большинство клеток |
Гл. 14, разд. 3,5,6 |
|
2. Мозговой слой надпочечников |
||
|
Адреналин, норадреналин (эпинефрин, норэпинефрин) |
То же |
Гл. 6, разд. Е,6; гл. 12, разд. Е, 1 |
|
3. Эпифиз |
||
|
Мелатонин |
Меланофоры |
Гл. 14, разд. И; рис. 14-27 |
|
4. Нервные и другие клетки Серотонин (5-окснтрнптамин) В. Стероиды и простагландины 1. Семенники Тестостерон |
Артериолы, центральная нервная система Большинство клеток |
Гл. 12, разд. И,3,в |
|
2. Яичники Эстроген (17β-эстрадиол) |
То же |
Гл. 12, разд. И,3,г |
|
3. Желтое тело Прогестерон |
Матка, молочные железы |
Гл. 12, разд. И,3,а |
|
4. Кора надпочечников Кортикостерон, кортизол |
Большинство клеток |
Гл. 11, разд. Е,2 и Е,7; гл. 12, разд. И,3,6 |
|
Альдостерон |
Почки |
Гл. 12, разд. И,3,6 |
|
5. Различные ткани Простагландины |
Гладкие мышцы |
Гл. 12, разд. Д,3 |
По длине пептидных цепей гормоны гипофиза значительно различаются между собой. Некоторые из них относятся к белкам среднего молекулярного веса. Например, гормон роста человека имеет мол. вес. 21 500 и характеризуется высокой специфичностью: гормоны роста из других источников не могут его заменять. Гормон, стимулирующий функцию щитовидной железы (тиреотропин, ТТГ), представляет собой гликопротеид с мол. весом 28 000. С другой стороны, гормоны нейрогипофиза (задней доли гипофиза) вазопрессин и окситоцин являются простыми пептидами, построенными всего лишь из 9 аминокислотных остатков (собственно, из восьми, если считать цистин одной аминокислотой; рис. 2-2). Как указывает уже само название, нейрогипофиз состоит из нервной ткани, секреторная функция которой находится под непосредственным контролем центральной нервной системы. Вазопрессин является основным фактором, регулирующим объем циркулирующей крови и артериальное давление; на уровень секреции этого гормона оказывает влияние стресс. Окситоцин действует на гладкие мышцы матки при родах, а также служит триггером лактации. Выделение молока, из молочных желез в определенной мере зависит от сосательных движений младенца, под влиянием которых происходит рефлекторное высвобождение окситоцина в кровоток.
Интересно проследить взаимосвязь между различными гормонами гипофиза. Часть из них содержит одинаковое гептапептидное звено следующей структуры:

В кортикотропине (рис. 2-2) присутствует не только указанный гептапептид, но и целиком вся последовательность аминокислот а-меланотропина, к С-концу которой присоединены еще 29 других аминокислот. Тот же гептапептид обнаруживается в липотропинах, также секретируемых гипофизом. Молекулы липотропинов содержат 46 аминокислот, присоединенных к одному концу гептапептида, и 5—37 аминокислот, присоединенных к другому концу (С-концу). Наличие общего гептапептида указывает на эволюционную взаимосвязь гормонов этой группы. Более того, кортикотропин может служить предшественником а-меланотропина и других биологически активных пептидов [9]. Создается впечатление, что процессинг (модификация) белковых и пептидных гормонов в результате посттранскрипционного расщепления протеазами или под влиянием других воздействий является очень распространенным общебиологическим феноменом [10, 11] (гл. 11, разд. Д, 2).
Еще одним примером может служить паратирин (паратгормон), состоящий из 84 аминокислотных остатков. В секреторных гранулах этот пептид присутствует в виде прогормона, содержащего 90 аминокислотных остатков, где 6 дополнительных аминокислот присоединены к N-концу. Первичный же продукт биосинтеза препропаратирин содержит, по-видимому, 25 дополнительных аминокислотных остатков на N-конце молекулы [11а, 11b]. Следовательно, преобразование в активный гормон включает по меньшей мере два предварительных этапа последовательного «обстругивания» продукта биосинтеза — препроцессинг и пропроцессинг. Аналогичная ситуация имеет место в случае инсулина, где препроинсулин расщепляется сначала с образованием проинсулина (рис. 11-9), после чего проинсулин подвергается воздействию протеазы с трипсиноподобными свойствами.
Было высказано предположение, что превращение ряда прогормонов в активные гормоны происходит путем аминолиза, а не гидролиза пептидной цепи. Расщепление посредством замещения на NH3 приводит к появлению на С-конце пептида амидной группы, которая весьма часто обнаруживается в пептидных гормонах небольшого молекулярного веса. Вазопрессин, окситоцин, а-меланотропин, либерины и некоторые другие гормоны образуются, по-видимому, таким путем.
Предполагается также, что ковалентные модификации (например, путем фосфорилирования) участвуют в механизмах регуляции, контролирующих накопление прогормонов или длительность действия активных гормонов [11].
Среди гормонов желудочно-кишечного тракта, перечисленных в табл. 16-1, фигурируют гастрин и секретин; это относительно небольшие полипептиды, содержащие 17 и 27 аминокислот соответственно [12]. Привлекает внимание гормон почек ренин, который, действуя как специфическая протеаза, отщепляет декапептид проангиотензин от сывороточного а2-глобулина [1]. Проангиотензин подвергается воздействию другого фермента [13], который отщепляет еще две аминокислоты с С-конца, в результате чего образуется ангиотензин — самое мощное из известных гипертензивных соединений.
![]()
Ангиотензин вызывает сокращение гладких мышц сосудов. Он снижает кровоток в почках и уменьшает выделение из организма жидкости и солей. Кроме того, под действием этого гормона увеличивается секреция альдостерона корой надпочечников, что приводит к повышению реабсорбции ионов натрия.