Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Рост, дифференцировка и химическая коммуникация клеток
Нейрохимия
Нейромедиаторы
В результате изучения нервно-мышечных соединений, образованных автономной нервной системой, еще в 1904 г. было высказано предположение, что нервные окончания высвобождают адреналин (эпинефрин). Хотя позднее выяснилось, что в действительности химическим медиатором является норадреналин1), принципиально важно, что была сформулирована концепция химической передачи в синапсах. В 1921 г. удалось показать, что окончания парасимпатических нервов выделяют ацетилхолин, а в дальнейшем стало ясно, что ацетилхолин выделяется также окончаниями двигательных нервов соматической системы1).
1) Адреналин служит медиатором в нервно-мышечных соединениях у земноводных; у млекопитающих это соединение функционирует в первую очередь как гормон.
а. Холинэргические синапсы
Появление электронной микроскопии сделало возможным детальное изучение структуры синаптических соединений. В настоящее время установлено, что в синаптических нервных окончаниях имеются пузырьки (везикулы) диаметром ~30—80 нм, которые, как было позднее показано методами химического анализа и гистохимического окрашивания, содержат нейромедиаторы (рис. 16-3). В тех случаях, когда передача сигнала осуществляется с помощью ацетилхолина (холинэргические синапсы), каждый пузырек диаметром 80 нм содержит ~40000 молекул ацетилхолина [40], так что концентрация последнего в пузырьке составляет примерно 0,5 М. Появление метода электрофоретического введения веществ (микроионофореза) позволило доказать, что высвобождение ацетилхолина в синапсе стимулирует постсинаптическую мембрану и тем самым инициирует возникновение импульса в постсинаптическом нейроне [41]. Используя ультрамикрокапилляры и небольшие толчки тока порядка 3∙108 имп./мс, можно ввести вещество непосредственно в синаптическую щель. Физиологический эффект регистрируют с помощью электродов, один из которых помещают в аксон или в мышечное волокно. Таким способом было показано, что введение ацетилхолина в количествах, сравнимых с теми, которые высвобождаются в участках нервно-мышечных соединений, действительно вызывает мышечное сокращение.
Как происходит высвобождение нейромедиатора? Путем изучения миниатюрных потенциалов концевых пластинок удалось установить, что высвобождение медиатора идет «квантами», т. е. путем полного опорожнения каждого отдельного пузырька. Миниатюрные потенциалы представляют собой флуктуации постсинаптического потенциала, наблюдаемые при слабой стимуляции пресинаптического нейрона. Эти флуктуации соответствуют случайному высвобождению медиатора из отдельных синаптических пузырьков [42]. В нормальных условиях под влиянием сильного импульса выделяется примерно 100—200 квантов медиатора — количество, достаточное для инициирования потенциала действия в постсинаптическом нейроне. Какие химические процессы стимулируют высвобождение нейромедиатора? Видимо, деполяризация мембраны синаптических окончаний вызывает быстрый ток ионов кальция в клетку [43, 44]. Временное увеличение внутриклеточной концентрации Са2+ стимулирует слияние мембраны синаптических пузырьков с плазматической мембраной и таким образом запускает процесс высвобождения их содержимого. Для выброса содержимого одного пузырька требуется примерно четыре нона кальция. Синаптические пузырьки покрыты оболочкой, напоминающей по структуре решетку и образованной одним белком — клатрином (мол. вес. 180 000). Каково значение этой оболочки, пока еще неясно.
После выделения медиатора синаптические пузырьки восстанавливаются. Этот процесс идет очень быстро, что видно хотя бы из следующего: количество пузырьков в обычном пресинаптическом окончании может обеспечить примерно 2000—5000 импульсов, что при сильной стимуляции достаточно только для нескольких минут работы. Следовательно, синаптические окончания аксонов должны обладать очень мощным механизмом синтеза и накопления нейромедиаторов. Кроме того, в нейронах идет процесс реабсорбции медиатора из синаптической щели и накопления его для повторного использования.
1) Роль ацетилхолина как химического медиатора в синапсах общепризнана. Однако Нахманзон [38, 39] выступает против этой точки зрения, указывая, что я распространение потенциалов действия также связано с процессами образования, накопления, высвобождения и гидролиза ацетилхолина (см. разд. Б,8).
Каков механизм действия медиатора на постсинаптическую мембрану? В случае ацетилхолина он состоит в деполяризации мембраны и увеличении проницаемости по отношению к ионам натрия и калия. Собственно, это, по-видимому, те же изменения мембраны, которые обусловлены возникновением потенциала действия (гл. 5, разд. Б, 3) при проведении нервного импульса. Ацетилхолин связывается со специальным рецептором, в результате чего натриевые каналы в мембране каким-то образом открываются. Из электрических органов электрического угря недавно был выделен белок большого молекулярного веса, обладающий, по полученным данным, свойствами рецептора ацетилхолина [45]. Имея мол. вес ~ 330 000, этот белок представляет собой, видимо, тример из субъединиц с мол. весом ≈110 000, в свою очередь состоящих из 2—4 пептидов с мол. весом 34 000—54 000. Каким образом функционирует этот рецептор, пока неизвестно (гл. 5, разд. В, 5).
Совершенно очевидно, что после выделения медиатора должна наступить фаза его быстрой инактивации или удаления с тем, чтобы подготовить синапс к восприятию нового импульса. В холинэргических синапсах это происходит двумя путями. Прежде всего ацетилхолин подвергается гидролитическому расщеплению ацетилхолинэстеразой (дополнение 7-Б), присутствующей в самой синаптической мембране. Второй путь — это энергозависимый активный транспорт ацетилхолина в нейрон, где он накапливается для последующего повторного использования.
К числу нейронов, выделяющих ацетилхолин, относятся моторные нейроны, образующие нервно-мышечные соединения, все преганглионарные нейроны автономной нервной системы и постганглионарные нейроны парасимпатической нервной системы. Большое количество других холинэргических синаптических областей обнаружено также в головном мозге.
При изучении нейромедиаторов важное значение имеет подбор специфических агонистов, имитирующих действие медиатора, или антагонистов, блокирующих это действие. В зависимости от чувствительности к одной или другой группе соединений холинэргические нейроны делятся на мускариновые (активируемые мускарином, рис. 16-6) или никотиновые (активируемые никотином) [46]. Мускариновые рецепторы, имеющиеся во многих нейронах автономной нервной системы, специфически блокируются атропином и декаметонием (рис. 16-6). Никотиновые синапсы присутствуют в ганглиях и скелетных мышцах. Их ингибиторами являются кураре и активный компонент этого яда D-тубокурарин (рис. 16-6), а также белок из змеиного яда а-бунгаротоксин (рис. 16-7). Этот токсин был, в частности, использован для титрования рецепторов ацетилхолина в моторной концевой пластинке диафрагмы крысы. Было показано, что количество рецепторов в расчете на одну пластинку составляет примерно 4∙107 (или 13 000 рецепторов на 1 мкм2) [47]. Токсические белки из ядов змей имеют очень сходную структуру [48, 49]. Для одного из них определена трехмерная структура [49а].
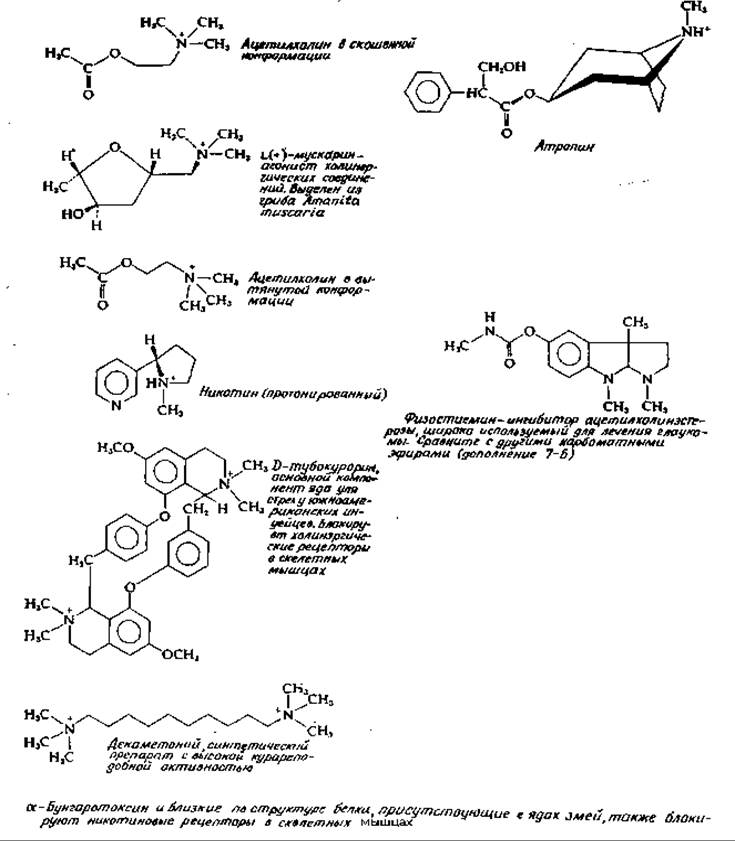
РИС. 16-6. Ингибитор холинэргических синапсов.
Было высказано предположение, что строение мускариновых рецепторов приспособлено к связыванию ацетилхолина в скошенной конформации, имеющей структурное сходство с мускарином (рис. 16-6) [49b]. Никотиновые рецепторы, напротив, связывают ацетилхолин в его максимально вытянутой конформационной форме. Однако сходство последней с никотином выступает не совсем ясно (рис. 16-6), и потому были высказаны другие предположения относительно природы различий двух видов ацетилхолиновых рецепторов.
Существует тяжелая болезнь — миастения (myasthenia gravis) (предположительно аутоиммунной природы; разд. В, 7), при которой наблюдается уменьшение числа функционирующих постсинаптических рецепторов [50, 51]. В результате возникает тяжелейшая мышечная слабость, нередко с летальным исходом. Любопытный метод лечения заболевания заключается во введении физостигмина (рис. 16-6), диизопропилфосфата (гл. 7, разд. Г, 1) и других ингибиторов ацетилхолин-эстеразы (дополнение 7-Б). Эти крайне токсичные соединения при использовании в строго контролируемом количестве способствуют накоплению ацетилхолина и в конечном итоге мышечному сокращению1).
1) Эти же вещества широко используются, при лечении глаукомы.
Помимо антагонистов, которые оказывают прямое воздействие на рецепторы, существуют ингибиторы, влияющие на ряд других этапов передачи импульсов. Например, токсин, вызывающий ботулизм, — одно из наиболее ядовитых веществ в природе — тормозит высвобождение ацетилхолина из синаптических пузырьков; такое же действие оказывает яд некоторых змей [52, 53]. Тетродотоксин (рис. 16-7) из рыбы рода Spheroid.es блокирует натриевые каналы в постсинаптической мембране, а тем самым и нервную передачу [54]. Сакситоксии (рис. 16-7) [55] обладает аналогичным действием. Батрахотоксии (рис. 12-8) [56] увеличивает проницаемость мембран мышечных клеток для ионов натрия. Столбнячный токсин, белок большого молекулярного веса, блокирует передачу импульсов в центральной нервной системе и в нервно-мышечных соединениях, вероятно, путем нарушения транспорта кальция [57].
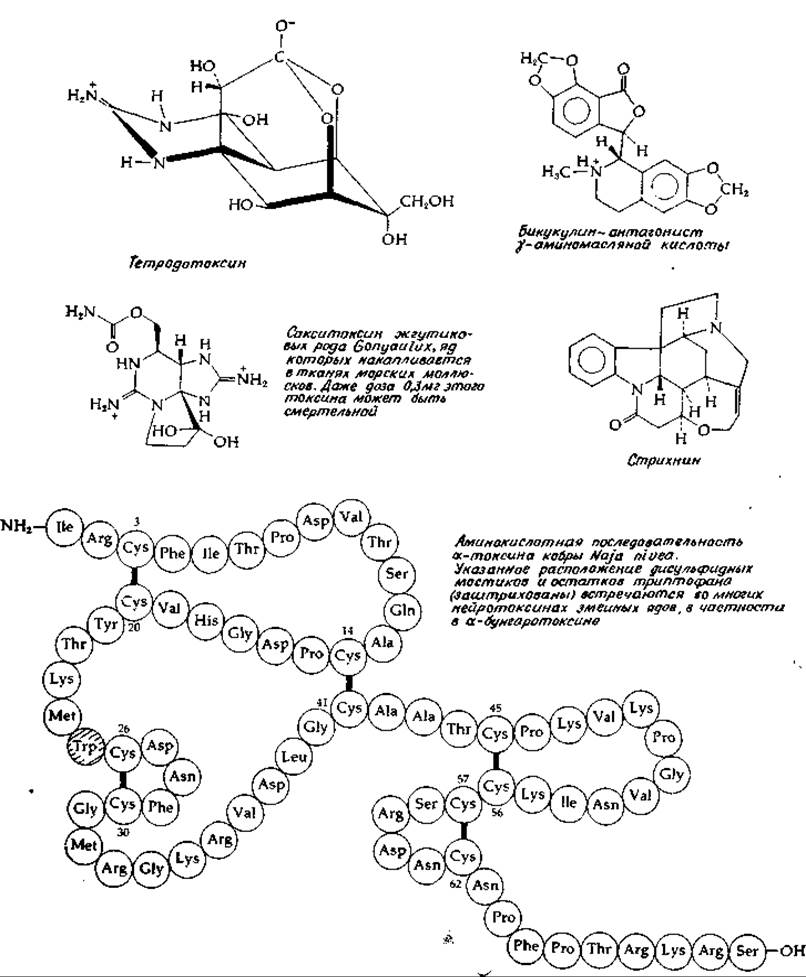
РИС. 16-7. Структура ряда нейротоксинов. Структура некоторых других нейротоксинов приводилась ранее: уабаина и батрахотоксина на рис. 12-18 и пикротоксина — на рис. 12-13.
б. Другие нейромедиаторы
Ацетилхолин представляет собой типичный нейромедиатор, удовлетворяющий следующим пяти основным критериям: 1) синтез ацетилхолина осуществляется в пресинаптическом нейроне (путем переноса ацетильной группы от ацетил-СоА под действием специфической ацетил-трансферазы); 2) существует механизм накопления ацетилхолина (в пузырьках); 3) выделение ацетилхолина пропорционально силе стимула (частоте импульсации); 4) постсинаптическое действие медиатора может быть прямо продемонстрировано методом микроионофореза; 5) имеются эффективные механизмы инактивации медиатора. Только соединения, удовлетворяющие указанным пяти критериям, могут быть отнесены к категории медиаторов.
В настоящее время установлено, что помимо ацетилхолина нейромедиаторами являются норадреналин, адреналин (у амфибий) и у-аминомасляная кислота (ГАМК). Известно также большое количество соединений — «кандидатов» на роль медиаторов. К ним относятся дофамин, 5-окситриптамин (серотонин), глутаминовая кислота и глицин, в пользу медиаторной функции которых накапливается все больше данных. В отношении других соединений, таких, как аспарагиновая кислота, таурин и ряд пептидов, в том числе гипоталамические либерины, вопрос окончательно еще не решен [58]. Возможно, что список несомненных нейромедиаторов будет быстро расти. Принято считать, что каждый отдельный нейрон высвобождает только один медиатор. Однако в настоящее время существуют некоторые сомнения относительно этого тезиса.
Глутаминовая кислота относится к важнейшим возбуждающим медиаторам в центральной нервной системе (ЦНС) беспозвоночных и, вероятно, играет важную роль и в нервной системе человека. Не исключено, что аспарагиновая кислота также является нейромедиатором. Как у-аминомасляная кислота, так и глицин считаются основными тормозными медиаторами. Если возбуждающие медиаторы вызывают деполяризацию постсинаптической мембраны, то тормозные медиаторы способствуют гиперполяризации, по-видимому, путем увеличения проводимости мембран в отношении К+ и Сl-. В результате в присутствии тормозных медиаторов возбуждение постсинаптической мембраны происходит с большим трудом, чем в их отсутствие.
в. Адренергические синапсы: катехоламины [30, 59, 60]
Важнейшими продуктами метаболизма в нейронах являются катехоламины, к которым относятся три близких по структуре производных тирозина: дофамин, норадреналин и адреналин. Дофамин и норадреналин служат нейромедиаторами. У многих беспозвоночных важную роль играет также октопамин [61], синтезирующийся из тирамина (рис. 16-8). Обратите внимание на взаимосвязь предшественник — продукт в ряду дофамин, норадреналин, адреналин. Путь биосинтеза этих нейромедиаторов включает реакции декарбоксилирования и гидроксилирования — типы реакций, имеющих место при образовании других медиаторов. Наиболее важным процессом, завершающим действие выделившихся катехоламиновых медиаторов, является обратное поглощение их нейронами. Характеризующаяся высокой степенью сродства система транспорта катехоламинов осуществляет их перенос назад в нейрон и накопление в специальных гранулах. Лекарственный препарат резерпин специфически тормозит процесс переноса (рис. 14-27). Значительная часть общего количества медиатора распадается под действием двух ферментов. Один из них — моноаминоксидаза (МАО, гл. 8, разд., И, 3), присутствующая в митохондриях нейрона (а также и во всех других клетках тела). Второй фермент — катехол — О-метилтрансфераза (КОМТ), обнаруженная в постсинаптических мембранах, в печени, почках и других тканях. Этот фермент служит, по-видимому, основным инструментом инактивации циркулирующих в крови катехоламинов.
Как адреналин, так и норадреналин стимулируют сокращение гладкой мускулатуры и вызывают повышение кровяного давления. Сравнение действия этих двух соединений и их различных аналогов позволило разделить постсинаптические рецепторы на два класса — а и ß. Стимуляция а-рецепторов оказывает, как правило, возбуждающее действие, но не на гладкую мускулатуру кишечника, деятельность которой при этом затормаживается. Специфическим антагонистом взаимодействия медиатора с а-рецепторами является дибенан (рис. 16-9). ß-Рецепторы обычно индуцируют расслабление мышц, но оказывают стимулирующее действие на сердечную мышцу. Норадреналин обладает, как правило, более высокой активностью, чем адреналин. В результате взаимодействия нейромедиатора с ß-рецепторами постсинаптической мембраны в большинстве случаев наступает гиперполяризация клеточной мембраны и проведение импульсов подавляется. Специфический антагонист в этом случае — пропранолол (рис. 16-9).
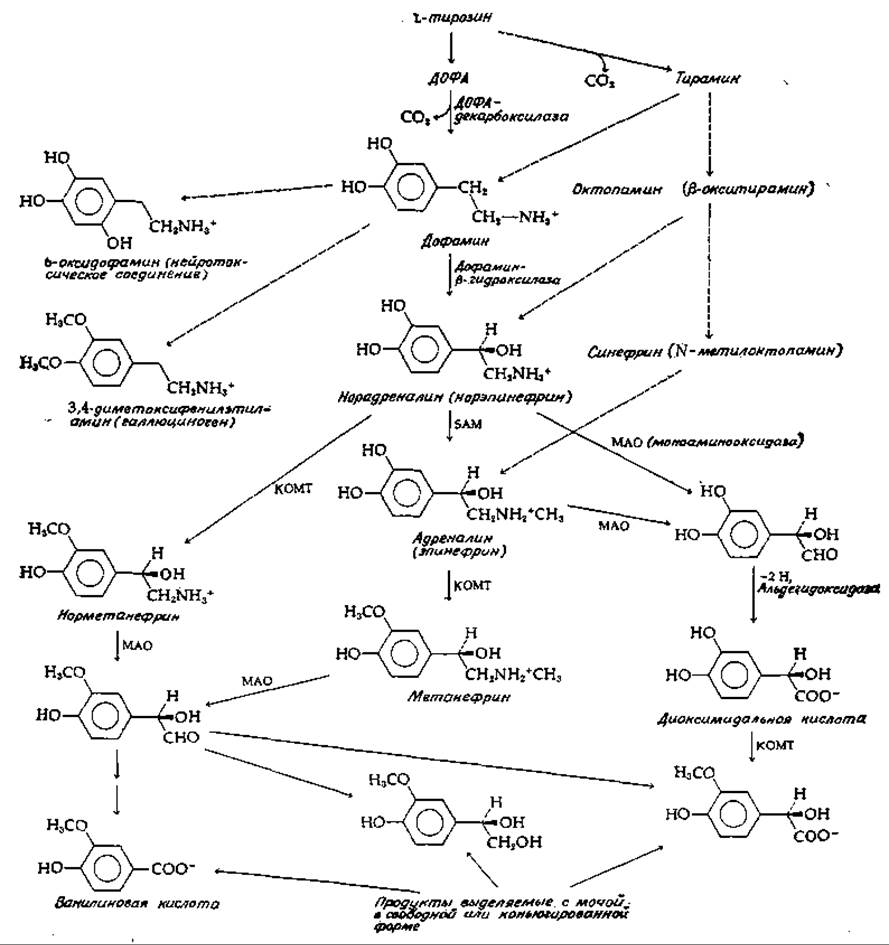
РИС.16-8. Некоторые пути превращения катехоламинов. См. также рис. 14-2.
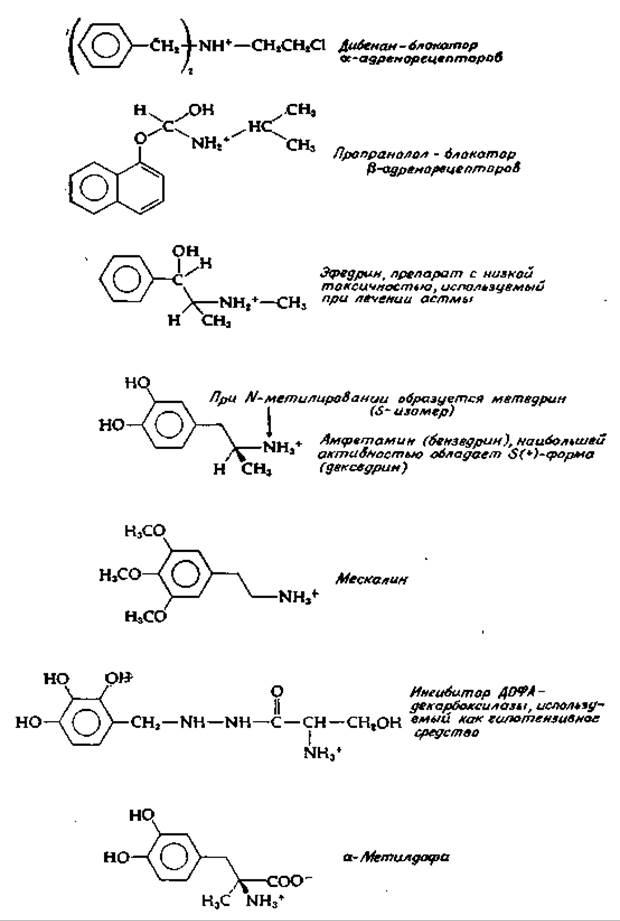
РИС. 16-9. Некоторые агонисты и антагонисты адренэргической синаптической передачи (в большинстве случаев представлены в виде катионов).
Если роль катехоламинов как медиаторов в симпатической нервной системе и в периферических ганглиях была установлена сравнительно легко, то их функция в центральной нервной системе только в настоящее время начинает проясняться. Катехоламины присутствуют в различных количествах во всех участках головного мозга, причем с помощью гистохимических флюоресцентных методов [62] можно выявить как дофамин-, так и норадреналинсодержащие нейроны: они обнаруживаются по зеленой флюоресценции, возникающей при обработке формальдегидом или глиоксилатом [63]. (Реакция, очевидно, аналогична изображенной на рис. 14-25.) Другой метод выявления дофаминовых рецепторов в центральной нервной системе связан с использованием специфических антител к дофамин-β-гидроксилазе [уравнение (10-57)] — ферменту, превращающему дофамин в норадреналин.
В настоящее время установлено, что в головном мозге, включая мозжечок и кору больших полушарий, повсеместно содержатся катехоламиновые нейроны. Очень крупные дофаминсодержащие нейроны были обнаружены в мозге брюхоногих моллюсков; проводится работа по изучению ответов индивидуальных нейронов этого типа [64].
Гистохимическими флюоресцентными методами в мозге крыс было показано наличие значительного количества дофаминсодержащих нейронов, идущих от substantia nigra к хвостатым ядрам и путамену полосатого тела. При паркинсонизме, сопровождающемся резко выраженным дрожанием и ригидностью мышц, обнаружена дегенерация нейронов этого нитростриарного проводящего пути. О значении дофамина в мозгу наиболее ярко свидетельствует тот факт, что, как оказалось, L-ДОФА, аминокислота — предшественник дофамина, является «чудодейственным» средством при лечении многих случаев паркинсонизма. Сущность лечебного действия заключается, видимо, в том, что дофамин становится более доступным для базальных ганглиев мозга и таким образом компенсируется дефицит дофамина, обусловленный дегенерацией нейронов1).
г. Циклические нуклеотиды
Хорошо известно, что адреналин активирует аденилатциклазу в мембранах клеток мышц и других тканей (гл. 6, разд. Е, 5). Имеются также убедительные данные о том, что аналогичным действием обладает норадреналин при взаимодействии с ß-рецепторами и дофамин (также путем активации определенных рецепторов) [64а]. В результате активации аденилатциклазы повышается содержание сАМР, что вызывает фосфорилирование определенных мембранных белков, медленную гиперполяризацию и уменьшение ответа на возбуждающую стимуляцию [65, 66]. Рассмотрим в качестве примера симпатические ганглии. Импульсы, выходящие из мозга по холинэргическим нервным волокнам, вызывают быструю деполяризацию постганглионарных нейронов, воздействуя через никотиновые холинэргические рецепторы. Однако нейроны, идущие к мозгу, также образуют синапсы с небольшими дофаминсодержащими вставочными нейронами, в свою очередь связанными через синапсы с теми же постганглионарными нейронами, которые возбуждаются под действием ацетилхолина. В результате после некоторой задержки происходит торможение синаптической передачи. Дело еще более усложняется тем, что активация постганглионарных мускариновых рецепторов ацетилхолина повышает активность гуанилатциклазы и соответственно ускоряет синтез cGMP. Это приводит к медленной деполяризации, поскольку действие двух циклических нуклеотидов направлено в противоположные стороны, хотя и не обязательно совпадает по величине [65—67]. Значение этих изменений, «модулирующих» холин-эргическую передачу, остается неясным.
1) Дофамин и другие катехоламины не проникают через гематоэнцефалический барьер, тогда как ДОФА проходит через него.
Повышение содержания циклических нуклеотидов способствует такт же, по-видимому, возникновению более стойких изменений в нейронах. Например, стимуляция хромаффинных клеток мозгового слоя надпочечников ацетилхолином, высвобождающимся в синапсах, индуцирует повышение активности тирозин—3-монооксигеназы, участвующей в образовании катехоламинов. Предполагается, что этот эффект обусловлен воздействием на цитоплазматическую протеинкиназу, которая проникает в ядро и оказывает влияние на богатый лизином гистон Н1 [67а].
д. Серотонин (5-окситриптамин)
Еще один предполагаемый нейромедиатор — это индолалкильный амин серотонин, обнаруженный в мозге всех млекопитающих, а также беспозвоночных. Он имеет ограниченное распространение, а именно серотонинсодержащие нейроны содержатся в срединных ядрах мозгового ствола. Эти нейроны идут в восходящем направлении в головной мозг и вниз в спинной мозг [68]. В нервных ганглиях улиток серотонинсодержащие волокна были выявлены с помощью меченного тритием серотонина [69]. Использование этого относительно просто устроенного объекта позволило обнаружить как торможение, так и возбуждение в ответ на раздражение указанных нейронов.
Серотонин синтезируется путем превращения триптофана в 5-окситриптофан и декарбоксилирования последнего (рис. 14-27). В эпифизе серотонин ацетилируется в N-ацетилсеротонин, который в свою очередь метилируется в гормон эпифиза мелатонин (рис. 14-27). Исследования, проведенные со специфическим ингибитором синтеза серотонина — n-хлорфенилаланином, а также с другими ингибиторами, дают основание думать, что серотонин необходим для сна [69а].
Содержание серотонина в мозге зависит от характера принимаемой пищи. Оно возрастает при употреблении в пищу большого количества углеводов. На основании этого было выдвинуто предположение, что серотонин, возможно, служит химическим сигналом, посылаемым одним видом нейронов в остальные части мозга, для информирования о характере потребляемой пищи [68, 69а]. О другой возможной функции серотонина свидетельствует тот факт, что торможение кортикостероидами секреторной активности гипофиза оказывается менее эффективным у тех животных, мозг которых был обеднен серотонином [70].
е. Глутаминовая кислота, у-аминомасляная кислота, глицин
Глутаминовая кислота и продукт ее декарбоксилирования у-аминомасляная кислота содержатся в высокой концентрации во всех частях мозга (гл. 9, разд. В, 1). Эти два соединения последовательно синтезируются в ходе реакций, образующих шунт у-аминомасляной кислоты; последний в количественном отношении составляет значительную часть всего обмена веществ мозга.
Роль глутамата как медиатора возбуждения была убедительно показана при изучении нервно-мышечных соединений членистоногих [71]. Подобным же образом на членистоногих, а именно при изучении особых тормозных нейронов, имеющихся в их нервной системе, была однозначно доказана функция у-аминомасляной кислоты как тормозного медиатора. Что касается роли этих соединений у позвоночных, то тут не все так ясно. Нередко, в частности, указывают, что вещества, присутствующие в столь высокой концентрации, должны играть в количественном отношении какую-то более существенную роль. Однако все же, видимо, на долю у-аминобутиратного шунта приходится менее 10% общего окислительного обмена мозга [72]. Концентрации у-аминомасляной кислоты в отдельных частях мозга могут различаться более чем в три раза, что в принципе соответствует распределению нейромедиаторов. В других тканях, кроме мозга, у-аминомасляная кислота практически отсутствует.
Глутаминовая кислота представляет собой один из основных компонентов всех животных тканей, но в мозге ее концентрация особенно высока, причем в нейронах выше, чем в глии. Введение глутамата в кору мозга методом микроинофореза вызывает очень сильную реакцию возбуждения. Следовательно, это вещество, как полагают, может оказаться основным медиатором возбуждения в центральной нервной системе. (Необходимо, однако, отметить, что введенные таким же образом аспарагиновая и цистеиновая кислоты также обладают мощным возбуждающим действием, но продукты их декарбоксилирования — ß-аланин и таурин — оказывают тормозящий эффект.)
Глутаминовая и у-аминомасляная кислоты быстро и специфически поглощаются клетками глии [73, 74], что служит еще одним доводом в пользу их медиаторной функции. Было высказано предположение, что в клетках глии глутамат превращается в глутамин, который далее транспортируется обратно в нейрон. Специфическими антагонистами у-аминомасляной кислоты являются вызывающие судороги алкалоиды бикукулин (рис. 16-7) [75] и пикротоксин (рис. 12-13). Одной из причин судорог может быть дефицит у-аминомасляной кислоты в мозге; судороги — это также один из наиболее ярких симптомов В6-авитаминоза. Полагают, что возникновение судорог под действием таких средств, как 1,1-диметилгидразин, обусловлено влиянием на пиридоксальфосфатзависимые ферменты (дополнение 8-Ж). При этом в первую очередь, по-видимому, нарушается активность глутаматдекарбоксилазы; снижение концентрации у-аминомасляной кислоты было действительно обнаружено в мозге животных либо с недостаточностью пиридоксина, либо получавших гидразиновые препараты. С другой стороны, однако, имеются данные, что при судорогах, индуцированных введением гидроксиламина, содержание у-аминомасляной кислоты увеличивается.
Специфическая недостаточность у-аминомасляной кислоты в базальных ганглиях лежит, видимо, в основе наследственного заболевания — хореи Хантингтона (болезнь поражает 4—7 человек из 100 000, причем преимущественно людей старше 40 лет) [76].
Вторым медиатором торможения, которому приписывается существенная роль в работе мозга человека, является глицин. В спинном и продолговатом мозге концентрация глицина достигает 3—5 мМ, но в коре больших полушарий он содержится в небольшом количестве. Стрихнин (рис. 15-7) служит специфическим антагонистом рецепторов глицина в спинальных синапсах. Имеются данные, что действие столбнячного токсина обусловлено торможением высвобождения глицина из нейронов [77, 78].
Препараты диазепам и хлордиазэпоксид (рис. 16-10) снимают ощущение тревоги, вызывают расслабление мышц; в США они принадлежат к числу наиболее часто рекомендуемых лекарственных препаратов. Эти соединения обладают способностью вытеснять меченный тритием стрихнин из комплекса с рецепторами ствола мозга и спинного мозга крыс; На этом основании было высказано предположение, что механизм действия указанных препаратов состоит в имитации эффекта глицина и в вытекающем отсюда постсинаптическом торможении [79].
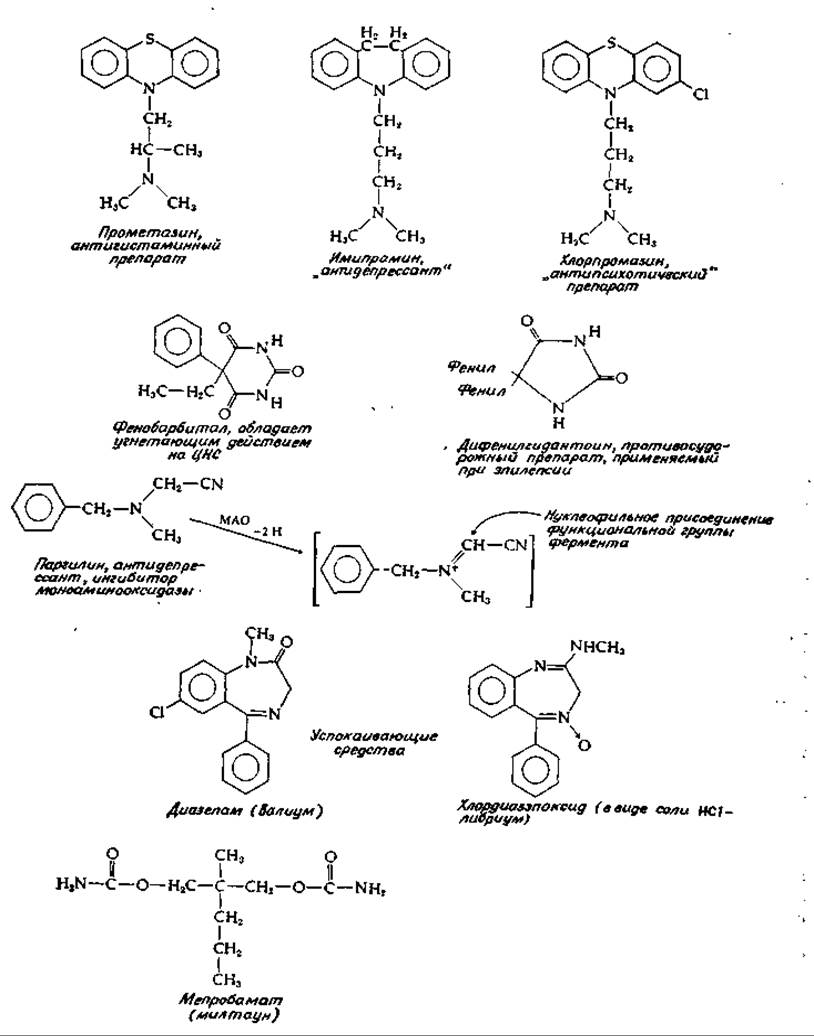
РИС. 16-10. Основные лекарственные препараты, применяемые для лечения психических расстройств
ж. Медиаторы пептидной природы
В 1931 г. из стволовой части мозга был выделен пептид, обозначенный как вещество Р. Он имеет следующую структуру [80]:
Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2.
Получены данные, свидетельствующие о том, что этот пептид выполняет в синапсах функцию медиатора или модулятора. Он присутствует в определенных сенсорных нейронах как центральной, так и периферической нервной системы [81].
Значительный интерес вызвали полученные относительно недавно данные о влиянии пептидных гормонов гипофиза, таких, как АКТГ, меланоцитстимулирующий гормон и вазопрессин, а также нейрогормонов гипоталамуса на способность к обучению и на поведение [82, 83]. Высказывалось предположение, что некоторые из указанных пептидов выполняют роль медиаторов. Любопытны также морфиноподобные пептиды (разд. Б, 6 данной главы), функционирование которых в качестве медиаторов вполне вероятно.