Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Свет в биологии
Зрение
Индуцируемые светом превращения
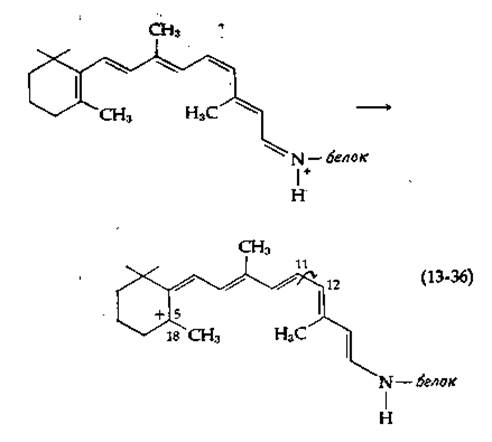
При освещении родопсина наблюдается последовательность легко регистрируемых спектральных изменений [133, 140]. Времена релаксации, указанные на схеме (13-35), получены при 20°С.

Первое превращение, зарегистрированное с помощью лазерного флеш-фотолиза и пикосекундной спектроскопии [141], протекает за 6∙10-12с (6 пс). Максимум поглощения образующегося батородопсина (прелюмиродопсина) сдвинут в сторону больших длин волн (батохромный сдвиг). Это свидетельствует об увеличении степени сопряжения, наблюдающемся, например, при изомеризации родопсина в полностью транс-ретиналь [уравнение (13-34)]. Маловероятно, однако, чтобы такое превращение могло произойти за столь короткое время, однако быстрое образование напряженного полностью транс-ретиналя возможно [141а]. Не исключен и простой перенос заряда с образованием карбоний-иона1) [схема (13-36)].
Последующий относительно медленный поворот вокруг указанной стрелкой одинарной связи может привести к образованию полностью транс-изомера, а отщепление протона от атома С-18 — к образованию соединения с дополнительной двойной связью между атомами С-5 и С-18. Именно такая структура была предложена для батородопсина [141с]. Среди других возможностей рассматривается образование бирадикала (в триплетном состоянии) [142], а также комплекса с переносом заряда с боковой цепью триптофана [143].
1) Недавно Матес и Страйер прямо подтвердили наличие переноса заряда по типу механизма (13-36) в шиффовом основании, образуемом ретиналем, находящемся в первом синглетном нозбужденном состоянии [141b].
Природа первой, фотохимической стадии, равно как и дальнейших превращений, идущих в темноте, пока точно неизвестна [141, 144]. Последовательность реакций (13-35) можно остановить на разных стадиях понижением температуры. При определенных условиях в этой последовательности появляется дополнительная стадия. Так, при 7 К первым наблюдаемым продуктом служит гипсородопсин, поглощающий при 437 нм (22 900 см-1). Большой интерес представляет этап превращения метародопсина I в метародопсин II, поскольку это самая медленная из стадий, которая еще могла бы служить для возбуждения нервного импульса (он проходит вдоль палочки до синапса примерно за 1 мс). Имеются указания, что этот этап сопровождается конформационными изменениями. Представления о природе последующих стадий, приводящих к высвобождению транс-ретиналя, носят довольно разноречивый характер. Однако эти стадии слишком медленные, чтобы играть заметную роль в инициации нервного импульса.
Каков возможный механизм инициации нервного импульса последовательностью реакций, приведенных на схеме (13-35)? Проще всего предположить, что конформационное изменение в молекуле ретиналя в процессе изомеризации 11-цис-ретиналя в полностью транс-ретиналь [схема (13-34)] индуцирует изменение конформации белка, что приводит к появлению у последнего ферментативной активности. Ферментом, инициирующим каскад химических превращений, кульминацией которых является нервный импульс, мог бы быть метародопсин II, но в пользу этого предположения нет никаких экспериментальных данных. Не исключено, что индуцированные конформационные изменения в молекуле белка открывают канал в мембране диска и какое-то вещество диффундирует по этому каналу наружу. В качестве возможного кандидата на роль указанного вещества все чаще рассматривается Са2+. Расстояние от мембран дисков до плазматической мембраны палочки таково, что высвободившееся вещество успеет достичь плазматической мембраны (где и возбуждается нервный импульс) за счет диффузии.
В мембранах дисков на долю родопсина, приходится 80% белка (или даже больше), и возможно, что «воротами», управляемыми действием света, является сам родопсин [145]. Соответствующий канал может проходить через каждую молекулу родопсина или идти вдоль оси олигомерного агрегата. В пользу данного предположения говорит тот факт, что две трети атомов водорода пептидных групп в мембранах дисков, по-видимому, образуют водородные связи с молекулами воды растворителя (судя по скорости водородно-тритиевого обмена) [146]. Этот факт особенно поразителен ввиду гидрофобности родопсина, а также в связи с тем, что в типичных глобулярных белках к быстрому обмену способна лишь треть протонов пептидных групп. Все сказанное можно объяснить, предположив, что большая часть протонов пептидных групп родопсина находится внутри канала, заполненного водой, и доступ в канал открывается действием света на шиффово основание, образуемое при связывании ретиналя с белком [146].
Возможно также, что имеет место кооперативный процесс передачи сигнала от одной из молекул родопсина на другой белок, находящийся на некотором расстоянии и контролирующий проницаемость мембраны. Можно даже допустить, что кооперативный процесс развивается настолько широко, что вдоль мембраны диска распространяется какой-то реальный физический сигнал, достигающий края диска и приводящий к генерации определенного химического сигнала вблизи плазматической мембраны.
Хорошо известно, что при увеличении интенсивности света, падающего на сетчатку, ее чувствительность быстро уменьшается. Это может быть обусловлено фосфорилированием какого-то участка молекулы родопсина опсинкиназой, которая специфически действует на выцветший родопсин. По-видимому, фосфорилированный родопсин менее проницаем для Са2+, чем «нормальный» [147]. Кроме того, выцветание родопсина вызывает активацию фосфодиэстеразы, которая особенно эффективно гидролизует циклический GMP [148]. Таким образом, действие света может вызвать многочисленные вторичные изменения, связанные со снижением концентрации cGMP.