Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Свет в биологии
Другие типы световых реакций
Биолюминесценция
Испускание живыми организмами видимого света относится к числу наиболее ярких и удивительных природных явлений. Люминесцирующие бактерии и грибы, простейшие, ответственные за свечение океана, светящиеся моллюски, фантастически освещенные черви и поражающие воображение светляки — все эти организмы постоянно привлекают к себе внимание биохимиков [162—164]. Наиболее интересна химическая сторона явления. Свет, испускаемый светляками, имеет длину волны ~560 нм (17 900 см-1) и энергию 214 кДж∙Эйнштейн-1. Возникает естественный вопрос: в ходе какой химической реакции высвобождается столь большое количество энергии? Ведь ее намного больше, чем может дать расщепление АТР. Даже окисление NADH кислородом едва ли способно обеспечить необходимую энергию.
Ключ к разгадке дает хемилюминесценция, часто наблюдаемая при использовании О2 в качестве окислителя в неферментативных процессах. Медленное окисление спиртов, альдегидов и многих азотистых соединений сопровождается испусканием видимого света. Наиболее ярко выражена хемилюминесценция в случае тех реакций, которые, как полагают, сопровождаются образованием свободных радикалов. При рекомбинации последних высвобождается достаточно энергии, чтобы могла произойти люминесценция в видимой области.
В свете всех этих данных способность многих организмов к преобразованию энергии, высвобождаемой в ходе реакции оксигенации, в световую энергию уже не кажется столь удивительной.
Попытки выделить из организмов светящийся материал восходят к прошлому столетию, когда французский физиолог Р. Дюбуа в 1887 г., получил из светящихся моллюсков два экстракта, используя для этого в одном случае холодную, а в другом — горячую воду [162]. Ему удалось показать, что если к соединению, полученному экстракцией холодной водой, которое он назвал люциферазой, добавить термостабильное соединение, экстрагированное горячей водой, наблюдается испускание света. Термостабильное соединение Дюбуа назвал люциферином. Эти названия сохранились и стали общепринятыми. Люциферины образуют семейство соединений; их структура установлена уже для многих видов организмов (рис. 13-30)
Люциферин светляков представляет собой карбоновую кислоту, которая активируется в ходе реакции, идущей с участием АТР, с превращением в люцифериладенилат (рис. 13-30). Это соединение в присутствии О2 и люциферазы испускает свет. Как видно из рисунка, карбоксильная группа отщепляется в виде СО2, а кольцо переходит в окисленную форму. Наряду с этим расщепляется ацил-аденилатная связь. У Renilla reniformis (кишечнополостное) люциферин имеет совершенно иную структуру [165], однако, как и у светляков, испускание света происходит в результате реакции с О2, приводящей к выделению СО2 и образованию окисленного продукта. У Renilla люциферин находится в виде люциферилсульфата; на рис. 13-30 изображена его возможная структура. Превращение этого соединения в активный люциферин осуществляется в результате переноса сульфурильной группы на аденозин-3'5'-дифосфат с образованием 3'-фосфоаденозин-5'-фосфосульфата, т. е. в ходе реакции, обратной стадии г в уравнении (11-4).
Другой интересной особенностью биолюминесценции у Renilla является присутствие в клетках, испускающих свет, особого зеленого флуоресцирующего белка. В отсутствие этого белка испускается сини свет С vmax = 20 500 см-1 (488 нм), а в его присутствии — свет в узко спектральной полосе с vmax = 19 600 см-1 (509 нм). По-видимому, при этом происходит эффективный перенос энергии между двумя хроме форами [164].
1) Читатель не должен забывать, что ученые, впервые исследовавшие люциферины, располагали очень малыми количествами материала, поэтому в старой литературе можно встретить ряд ошибок.
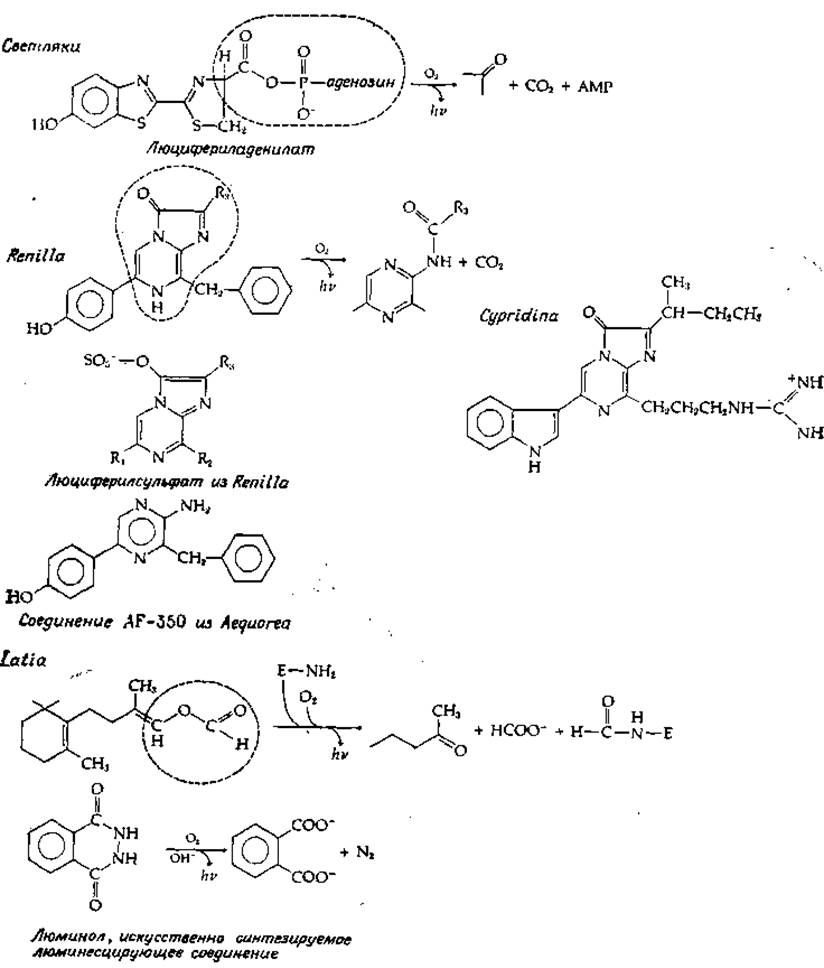
РИС. 13-30. Структура люциферинов из нескольких светящихся организмов. Приведенны формулы «активированных» молекул, «готовых» к реакции с О2. Однако соединении AF-350 является продуктом расщепления светящегося белка экворина, активируемого ионами Са2+.
Люциферин раков-отшельников Cypridina очень близок по структуре люциферину Renilla. У Cypridina люциферий и люцифераза синтезируются в разных железах и секретируются в окружающую водную среду, где происходит их смешивание и испускание света. Совсем иначе реакция, ведущая к испусканию света, используется блюдечком Latic Люциферин в этом случае представляет собой необычное терпеновое производное, не содержащее хромофора, способного испускать свет [166]. Очевидно, окисление этого люциферини вызывает электронное возбуждение какой-то другой молекулы, по всей вероятности, «пурпурного белка», также необходимого для люминесценции. Полагают, что комплекс люциферина и пурпурного белка вступает в реакцию с люциферазой (на рис. 13-30 она сокращенно обозначена как Е—NH2); при этом высвобождается формильная группа, ранее участвовавшая в образовании енольно-эфирной связи. Образующаяся альдегидная группа взаимодействует с аминогруппой фермента, а шиффово основание реагирует далее с кислородом [схема (13-40)]:
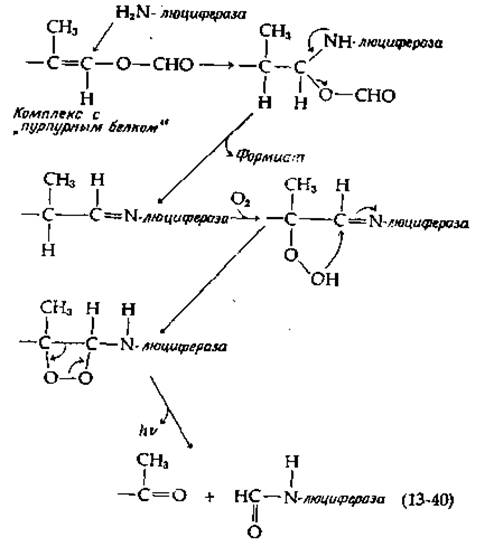
При описании механизма действия большинства люцифераз предполагается, что О2 реагирует с атомом углерода, который затем включается в состав карбонильной группы продукта. Для люциферина из Renilla такой процесс легко себе представить как результат переноса электрона от азота пиразина (рис. 13-30, внизу) на О2. В случае люциферина светляка перед взаимодействием с О2, по-видимому, происходит удаление протона при атоме углерода благодаря электроноакцепторным свойствам соседней циклической системы. Эту реакцию можно сравнить с реакциями, катализируемыми оксигеназами [например, с реакцией, описываемой уравнением (10-50)]. Согласно одному из предположений, образующаяся пероксидная группа присоединяется к карбонилу (к RC = N— в люциферине из Latia), в результате чего возникает четырехчленное диоксетановое кольцо [схемы (13-40) к (13-41)].
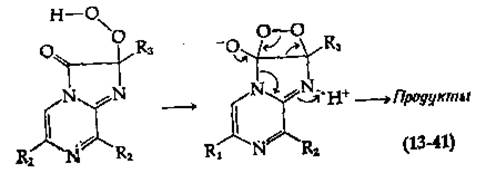
Это кольцо далее раскрывается в ходе согласованного процесса (как указано стрелками) с образованием конечных продуктов.
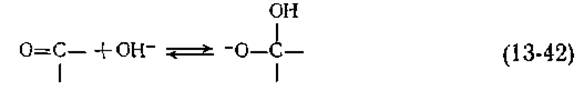
Правильность изложенной теории была проверена в опытах с использованием 18О2. В случае люциферина из Cypridina действительно наблюдалось включение одного атома 18О в молекулу СО2, при исследовании же люциферинов из светляков и Renilla никакого включения 18О в СО2 не происходило. Таким образом, в двух последних случаях механизм действия люциферазы иной. Возможно, к карбонильной группе присоединяется гидроксил-ион и образуется гидроперекисное промежуточное соединение, согласованный распад которого на продукты опять-таки сопровождается испусканием света. Эту идею подтверждает включение в СО2 двух атомов 18О из Н182О. Обмен обоих атомов кислорода СО2 может осуществляться в результате реакции (13-42) между аддуктом и растворителем.
Большое внимание привлекли к себе биолюминесцентные системы медузы Aequorea и родственных кишечнополостных [167]. Aequorea содержит фотобелок, испускающий свет в присутствии ионов кальция. Поскольку интенсивность испускаемого света можно измерять с высокой чувствительностью (современные фотоумножители позволяют производить подсчет числа световых квантов), белок экворин и родственные фотобелки в настоящее время используются как чувствительные индикаторы концентрации ионов кальция. (Аналогичным образом выделяемая из светляков система люциферин — люцифераза, для активации которой необходим АТР, широко используется как чувствительный метод оценки содержания АТР.)
Чтобы идентифицировать хромофор экворина, пришлось переработать более 4000 кг медуз, в результате чего было получено 125 мг электрофоретически чистого фотобелка [169]. Из этого количества был выделен 1 мг хромофора AF-350, формула которого приведена на рис. 13-30. Сходство данного хромофора с люциферинами из Renilla и Cypridina очевидно. Как предполагают, в интактном экворине с AF-350 «сочленяется» имидазольное кольцо. Было постулировано, что экворин и другие фотобелки содержат стабилизированное кислородсодержащее промежуточное соединение, в связи с чем для завершения реакции (13-41) не требуется дополнительного количества кислорода, а нужен только Са2+, изменяющий конформацию белка [170]. У рассматриваемых кишечнополостных также наблюдается перенос энергии на другие флуоресцирующие белки [171].
Совсем иные реакции, сопровождающиеся испусканием света, протекают у люминесцирующих бактерий. В этом случае восстановленный рибофлавин-5'-фосфат окисляется кислородом; при этом требуется присутствие альдегида с длинной цепью (например, пальмитальдегида). По-видимому, значительную часть энергии, испускаемой затем в виде света, поставляет окисление альдегида в карбоновую кислоту [уравнение (13-43); через FH2 здесь обозначен рибофлавин-5'-фосфат]:
FH2 + R - СНО + О2 → F + Н2О + R — СООН (13-43)
Спектр люминесценции бактерий совпадает со спектром флуоресценции окисленного флавинового кольца. Были получены данные, указывающие на образование бактериями связанной с ферментом гидроперекиси восстановленного флавина [как в уравнении (10-50)]. Эта гидроперекись распадается на флавин и Н2О2, а кроме того, она может окислять альдегид, что сопровождается испусканием света [172, 173]. Сообщалось также о присутствии в некоторых люциферазах неидентифицированного пока нового флавина [174].
Вопросы и задачи
1. Дайте определение следующих понятий: фотон, квант энергии, волновое число, эйнштейн, свет, поляризованный по кругу, спектр действия, флуоресценция, фосфоресценция.
2. Что такое принцип Франка — Кондона?
3. 0,1 мл раствора аденозина в дистиллированной воде разбавили нейтральным фосфатным буфером (pH 7,0) до объема 25 мл. Поглощение при 259 нм оказалось равным 0,77. Молярная экстинкция аденозина при 259 нм составляет 1,54∙104 М-1∙см-1. Какова концентрация исходного раствора аденозина? Каково пропускание разбавленного раствора при 259 нм?
4. Был снят разностный спектр раствора белка, имевшего поглощение 2,0 при 280 нм, и такого же раствора, содержащего, кроме того, аллостерический модификатор в заданной концентрации. В спектральной области 260—300 нм выявилась серия положительных и отрицательных полос. Когда эксперимент повторили с раствором белка, имевшим поглощение 3,0 при 280 нм, в который было добавлено соответственно в 1,5 раза больше аллостерического модификатора, высота максимумов и глубина минимумов на разностном спектре возросла значительно меньше, чем в 1,5 раза. Объясните почему.
5. Титрование остатков тирозина в белке можно провести спектрофотометрически. а. Объясните, как это можно сделать б. При какой длине волны (или длинах волн) вы стали бы проводить измерения? в. Покажите, что для соединения с одной диссоциирующей группой и значениями коэффициентов молярной экстинкции εНА для недиссоциированной и диссоциированной форм соответственно выполняется следующее соотношение (ε — кажущаяся молярная экстинкция при данном pH):
![]()
6. Кристаллы антрацена поглощают ультрафиолетовый свет при 339 нм. Рассчитайте высоту возбужденного энергетического уровня относительно основного уровня, выразив ее в ккал∙моль-1, В кДж∙моль-1 и в см-1.
7. Рассчитайте энергию одного Эйнштейна квантов для длин волн, соответствующих максимумам поглощения хлорофилла, т. е. 430 и 660 нм.
Почему молекулы, флуоресцирующие при комнатной температуре, обычно фосфоресцируют лишь при очень низких температурах (например, при —180°С)?
9. Молекулы хлорофилла при определенных условиях димеризуются. Как эта димеризация влияет на электронный спектр?
10. Какова дальнейшая судьба поглощенного фотона (исходя из того, о чем говорилось в тексте)? Какой из вариантов наиболее вероятен в случае функционирующих хлоропластов?
11. Что подразумевается под «световыми» и «темновыми» реакциями фотосинтеза?
12. Что служит исходным источником электронов, необходимых для восстановления NADP в зеленых растениях при фотосинтезе?
13. Почему «эффект усиления Эмерсона» (разд. Д, 1) не наблюдается у фотосинтезирующих бактерий?
14. Чем еще различаются процессы фотосинтеза у бактерий и у сине-зеленых водорослей или эукариотических растений?
15. В чем сходство между митохондриями и хлоропластами?
16. Механизм концентрирования СО2 (рис. 13-26), используемый в С4-растениях, может быть описан следующим уравнением:
(СО2 + NADPH)M + ATP → (СО2 + NADPH)о + 2Рi + АМР,
где индексы «м» и «о» соответствуют клеткам мезофилла и обкладки соответственно. Если принять отношение [АМР] [Рі]2/[АТР] равным 10-3, а концентрацию NADPH в обоих типах клеток считать одинаковой, то каким будет отношение концентраций [СO2]о/[СO2]M в равновесии?
17. В какие положения включится 14С через несколько секунд после начала фотосинтеза, идущего в присутствии 14СO2, в следующих молекулах: а) 3-фосфоглицерате, б) фруктозо-6-фосфате, в) серине, г) оксалоацетате?
18. Какая минимальная площадь сельскохозяйственных культур могла бы обеспечить посредством фотосинтеза ваши личные потребности в энергии?