Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Синтез и катаболизм соединений, входящих в семейство глутаминовой кислоты
Цикл мочевины
В 1932 г. Кребс и Хензелайт [33с] предположили, что в срезах печени мочевина образуется в ходе циклического процесса, в котором орнитин превращается сперва в цитруллин и далее в аргинин. Гидролитическое расщепление аргинина приводит к образованию мочевины и регенерации орнитина (рис. 14-4, внизу). Последующие эксперименты полностью подтвердили это предположение. Попытаемся проследить весь путь удаляемого в печени азота избыточных аминокислот. Транс-аминазы (стадия а, рис. 14-4, в центре справа) переносят азот на а-кетоглутарат, превращая последний в глутамат. Поскольку мочевина содержит два атома азота, должны быть использованы аминогруппы двух молекул глутамата. Одна из этих молекул прямо дезаминируется глутаматдегидрогеназой с образованием аммиака (стадия б). Этот аммиак присоединяется к бикарбонату (стадия в), образуя карбамоилфосфат, карбамоильная группа которого переносится далее на орнитин с образованием цитруллина (стадия г). Азот второй молекулы глутамата путем переаминирования переносится на оксалоацетат (реакция д) с превращением его в аспартат. Молекула аспартата в результате реакции с цитруллином целиком включается в состав аргининосукцината (реакция е). В результате простой реакции элиминирования 4-углеродная цепь аргининосукцината превращается в фумарат (стадия ж); в качестве продукта элиминирования образуется аргинин. Наконец, гидролиз аргинина (стадия з) дает мочевину и регенерирует орнитин.
Первой из стадий собственно цикла мочевины является образование карбамоилфосфата. Из двуокиси углерода и аммиака самопроизвольно в обратимой реакции образуется карбаминовая кислота:
![]()
Обычно орнитин не входит в состав белков. Однако сообщалось, что уратсвязывающий гликопротеид плазмы (мол. вес 67 000) содержит 43 остатка орнитина. Было сделано предположение, что для образования этих остатков используется специальная аргиназа, которая, вероятно, отсутствует в некоторых случаях подагры, когда сильно cнижена способность крови й связыванию уратов. [33а].
В ранних экспериментах у бактерий была обнаружена киназа, способная превращать карбамат в карбамоилфосфат:
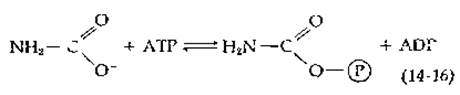
Однако константа равновесия в этом случае оказывается очень низкой (0,04 при pH 9, 10°С). Теперь считают, что карбаматкиназа обычно работает в обратном направлении, обеспечивая синтез АТР у бактерий, разлагающих аргинин (разд. В, 5, г).
Карбамоилфосфатсинтетазы сопрягают процесс образования одной молекулы карбамоилфосфата с распадом двух молекул АТР (реакция в рис. 14-4) [34]. У бактерий, таких, как Е. coli, имеется единая синтетаза, производящая карбамоилфосфат для биосинтеза и аргинина и пиримидинов (рис. 14-29). Однако в грибах и у высших животных таких ферментов два: карбамоилфосфатсинтетаза I поставляет субстрат для образования цитруллина из орнитина, а карбамоилфосфатсинтетаза II функционирует в синтезе пиримидинов. Синтетаза I находится в митохондриях, а синтетаза II — в цитоплазме.
Карбамоилфосфатсинтетаза Е. coli содержит биотин (гл. 8, разд. В, 2). Предполагают, что по ходу реакции образуется карбоксибиотиновое производное, карбоксилирующее аммиак с превращением его в связанный с ферментом карбамат, который фосфорилируется за счет АТР. Фермент состоит из двух субъединиц с мол. весом ∼ 130 000 и ~ 42 000. Поразительным свойством фермента Е. coli является его способность использовать в качестве донора аминогрупп любой из двух субстратов — свободный аммиак или глутамин [26, 35]. Более того, легкая субъединица обладает глутаминазной активностью — она способна гидролизовать глутамин с образованием аммиака. Фактически дело, видимо, обстоит так, что глутамин может гидролизоваться с освобождением свободного аммиака в активных центрах всех ферментов, катализирующих реакции, в которых донором азота служит аминогруппа глутамина. Тяжелая субъединица синтетазы не только содержит биотин, но и подвергается аллостерической модификации под действием ряда эффекторов. Орнитин и аммиак активируют фермент (рис. 14-4), а урацил, пиримидиновый конечный продукт, оказывает ретроингибирующее действие.
О содержании биотина в карбамоилфосфатсинтетазе млекопитающих данных не имеется, однако известно, что она тоже действует по многостадийному механизму. Считают, что первоначально образующийся карбоксилфосфат (связанный с ферментом) далее реагирует с аммиаком и превращается в связанный с ферментом карбамат. Для синтетазы печени мощным аллостерическим эффектором является N-ацетилглутамат (рис. 14-4), предшественник орнитина [17].
Продолжая далее обсуждение цикла мочевины, следует отметить, что константа равновесия реакции, катализируемой орнитинтранскарбамоилазой (реакция г, рис. 14-4), настолько высока, что орнитин полностью превращается в цитруллин. Превращение цитруллина в аргининосукцинат и последующий распад на фумарат и аргинин — процессы исключительно сложные.
Для реакции, катализируемой аргининосукцииат-синтетазой, установлено, что уреидогруппа цитруллина активируется с помощью АТР [уравнение (14-17), стадия а].
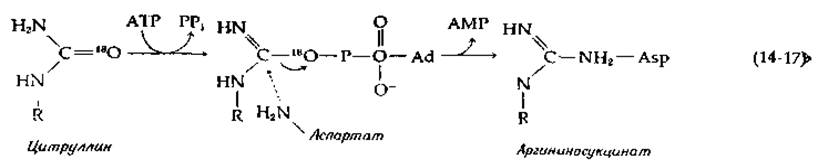
Таким образом, 180, присутствующий в составе уреидогруппы, переходит в молекулу АМР. Весьма вероятно, что реакция протекает с образованием цитруллинаденилата в качестве промежуточного соединения (средняя часть уравнения 14-17). Аргининосукциназа (рис. 14-4, реакция ж) катализирует элиминирование аргинина с образованием фумарата. Фермент полностью аналогичен бактериальной аспартазе, элиминирующей аммиак из аспартата и тоже образующей фумарат. Как и последний фермент (гл. 7, разд. 3,6, г), аргининосукциназа осуществляет транс-элиминирование. Фумарат может в ходе реакций цикла трикарбоновых кислот снова превращаться в оксалоацетат, который в свою очередь может быть реаминирован в аспартат.
Аспартат используется точно таким же образом для введения аминогрупп в ходе других метаболических последовательностей, например для образования адениловой кислоты из инозиновой кислоты (рис. 14- 32).
Расщепление аргинина с образованием орнитина переводит путь биосинтеза аргинина в цикл синтеза мочевины. Этот цикл присущ только организмам, экскретирующим азотистые шлаки в виде мочевины, тогда как путь, ведущий к биосинтезу аргинина, используется почти всеми организмами.
У взрослого человека выделение мочевины составляет приблизительно 20 г в день. При снижении этих количеств в крови может накапливаться аммиак, достигая токсического уровня. В норме плазма содержит 0,5 мг∙л-1 аммиака, и токсические симптомы проявляются уже при превышении этого уровня в 2—3 раза. И неудивительно, что обнаружен ряд наследственных нарушений в ферментной системе, принимающей участие в цикле мочевины. Одно из наиболее распространенных нарушений (аргининосукцинацидурия) связано с отсутствием способности к расщеплению аргининоянтарной кислоты. Известны как летальные, так и нелетальные варианты этой болезни. Описано свыше 20 нелетальных случаев. Для всех наследственных нарушений цикла мочевины характерны непереносимость богатой белками пищи, а также- и психические расстройства. Токсическое накопление аммиака в крови часто наблюдается при алкогольном циррозе печени, что объясняется: пониженной способностью печени к синтезу мочевины.