Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Синтез и катаболизм соединений, входящих в семейство глутаминовой кислоты
Полиамины
Полиамины составляют ряд родственных соединений, частично образующихся из аргинина; они присутствуют во всех клетках в относительно больших количествах (зачастую в миллимолярных концентрациях). Содержание полиаминов в клетках часто находится в стехиометрическом соотношении с содержанием РНК. Однако у Т-четных бактериофагов и большинства бактерий содержание полиаминов ассоциировано с ДНК. Полиаминам приписывают множество функций. Они могут в известной мере замещать клеточный К+ и Mg2+ и, видимо, играют существенную регуляторную роль в процессах синтеза нуклеиновых кислот и белков [36]. Спермидин, по всей вероятности, играет специфическую роль в процессе клеточного деления [40а]. Полиамины могут взаимодействовать с двойной спиралью нуклеиновых кислот, образуя мостики между полинуклеотидными цепями; в этом случае положительно заряженные аминогруппы взаимодействуют с отрицательно заряженными фосфатами остова нуклеиновых кислот [40]. В одной модели (предложенной Тсубои [40b]) тетраметиленовая часть молекулы полиамина укладывается в малой бороздке, связывая три пары оснований, а триметиленовые группы (одна в спермидине и две в спермине) образуют мостики между смежными фосфатными группами в одной цепи. Полиамины могут также стабилизировать суперспиральную или свернутую структуру ДНК.
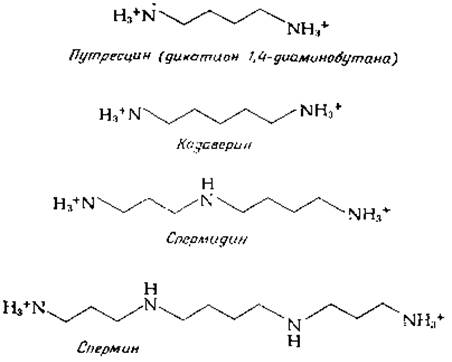
Построенный из четырех углеродных атомов путресцин проще всего получается в результате декарбоксилирования орнитина. Однако он может также образовываться путем декарбоксилирования аргинина в агматин и последующего гидролиза агматина [37]:
![]()
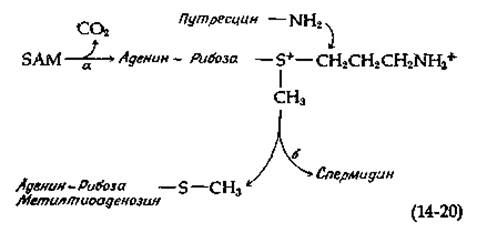
Путресцин присутствует во всех клетках, причем все клетки способны превращать его в спермидин. Это осуществляется путем декарбоксилирования S-аденозилметионина (SAM) [уравнение (14-20), стадия а] и переноса пропиламиногруппы с продукта декарбоксилирования на аминогруппу путресцина [уравнение (14-20), стадия б] [41].
Когда клетки Е. coli вступают в стационарную фазу роста (гл. 6, разд. В), большая часть спермидина превращается в глутатионилспер-, мидии (а-глутамилцистеинилглицилспермидин) [42]. Наряду с этим происходит ацетилирование спермидина.
Имеющий более сложное строение спермин обнаружен только у эукариотов. Интересный исторический факт состоит в том, что Антони фон Левунгук еще в 1678 г. наблюдал в один из своих первых микроскопов кристаллы фосфорнокислой соли спермина в составе спермы человека. Пятиуглеродный диамин кадаверин получается в результате декарбоксилирования лизина.
Функции полиаминов и их дальнейший метаболизм только теперь стали объектом интенсивных исследований. В клетках Е. coli 1,4-диаминобутан подвергается переаминированию, превращаясь в а-аминобутиральдегид, который циклизуется [уравнение (14-21)]. Диаминоксидазы животных тканей окисляют 1,4-диаминобутан с образованием тех же продуктов. Медьсодержащая оксидаза из сыворотки крови быка окисляет спермидин в моноальдегид, а спермин — в диальдегид [38]. Хотя оба эти соединения сильно токсичны, существует предположение, что они играют существенную роль в регуляции внутриядерного метаболизма.
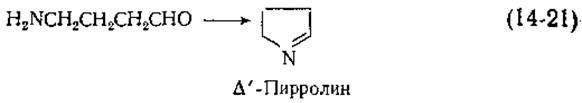
В организме животных, по-видимому, происходит также окислительный распад спермина с образованием спермидина; последний окисляется в 1,4-диаминобутан, который в заметных количествах экскретируется с мочой [38].