Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Соединения, образующиеся из аспартата
С аспартата, молекула которого построена из четырех атомов углерода, начинаются пути синтеза пиримидинов и ряда аминокислот — лизина, метионина, изодейцина и аспарагина. Соответствующие метаболические пути суммированы на рис. 14-6. Обратите внимание на несколько имеющихся мест ветвления. Аспартат может быть непосредственно превращен в аспарагин, в карбамоиласпартат (предшественник пиримидинов), ß-аспартилфосфат или полуальдегид аспарагиновой кислоты. Последний в реакциях одного пути может быть превращен в лизин, а в реакции другого — в гомосерин. Гомосерин может превратиться либо в гомоцистеин и метионин, либо в треонин. Хотя треонин является одним из конечных продуктов и непосредственно входит в состав белков, он может далее превратиться в а-кетобутират, являющийся предшественником изолейцина.
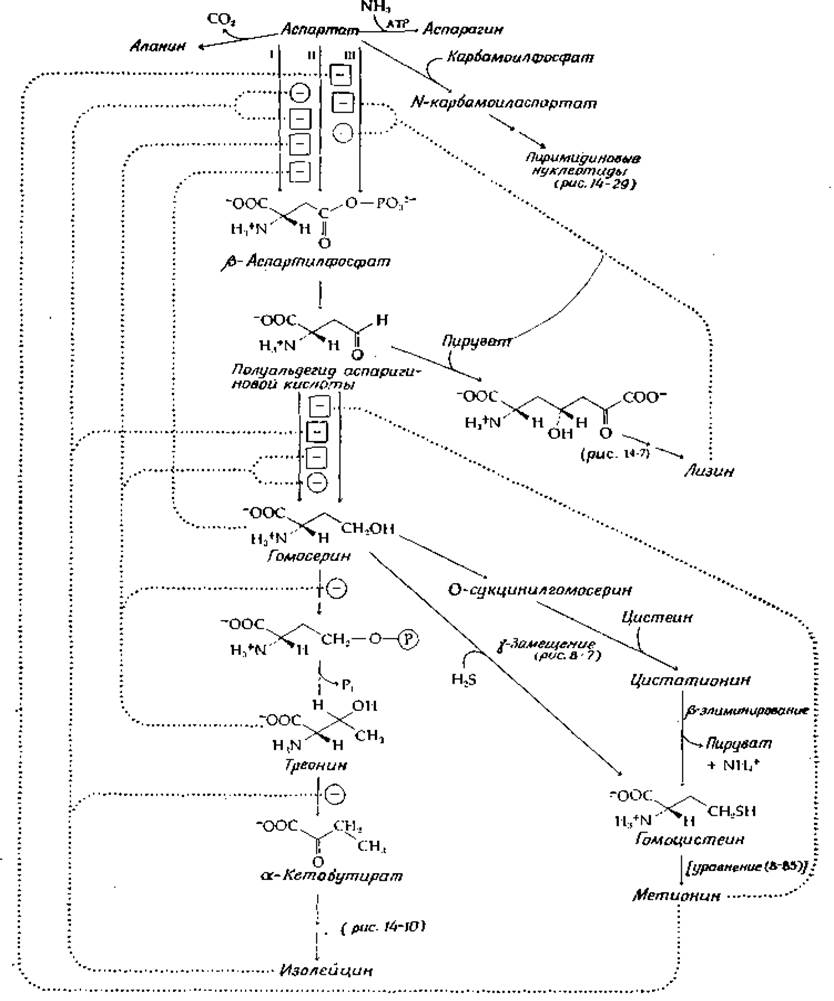
РИС. 14-6. Некоторые реакции биосинтеза аспарагиновой кислоты; знаком «минус» в кружочке обозначено ингибирование, знаком «минус» в квадрате — репрессия (по типу обратной связи).
Большую часть химических стадий мы уже рассматривали. Восстановление аспартата через ß-аспартилфосфат проходит стандартным образом. Превращение в метионин может идти двумя путями. У Е. coli томосерин сукцинилируется за счет сукцинил-СоА. у-Сукцинильная труппа далее замещается на молекулу цистеина в результате PLP-зависимой реакции у-замещения (рис. 14-6). Продукт этой реакции цистатионин [уравнение (8-22)] подвергается β-элиминированию с образованием гомоцистеина. С другой стороны, у нейроспоры происходит более прямое у-замещение гидроксильной группы гомоцистеина на сульфид-ион. Метилирование гомоцистеина с превращением его в метионин было рассмотрено ранее [уравнение (8-45)], так же как и превращение гомосерина в треонин под действием PLP-зависимой треонинсинтетазы (гл. 8, разд. Д, 3,г). Стандартное PLP-зависимое ß-эли- минирование превращает треонин в а-кетобутират, предшественник изолейцина (рис. 14-10).
Образование аспарагина происходит аналогично образованию глутамина. Однако аспарагинсинтетаза Е. coli [45] расщепляет АТР на АМР и РРі без образования ADP. Считают, что по ходу процесса образуется ß-аспартиладенилат. У высших животных донором аммиака для синтеза аспарагина служит глутамин, но может быть использован и непосредственно NH+4 [46].
L-аспарагиназа, бактериальный гидролизующий фермент, оказалась эффективным лекарственным препаратом при лейкемии; при инъицировании в кровь она снижает поступление в опухолевые клетки экзогенного аспарагина, необходимого для их быстрого роста [47]. Однако под действием этого фермента поражаются также ткани с низкой активностью аспарагинсинтетазы, что ограничивает клиническое использование аспарагиназы.