Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Серин и глицин
Катаболизм глицина
Если образование глицина из глиоксилата происходит путем переаминирования, то обратное превращение избытка глицина в глиоксилат, может осуществляться с помощью оксидазы аминокислот (табл. 8-4). О том, что и этот путь в количественном отношении имеет для человека важное значение, свидетельствует существование гипероксалурин типа I [67]. Полагают, что в этом случае блокируется один из обычных путей утилизации глиоксилата, вместо которого происходит его окисление в оксалат. Природа биохимического нарушения еще не ясна, но возможно, что причина заложена в тиаминзависимом ферменте, катализирующем конденсацию глиоксилата с а-кетоглутаратом, приводящую к образованию 2-окси-З-кетоадипината [уравнение (14-31)].
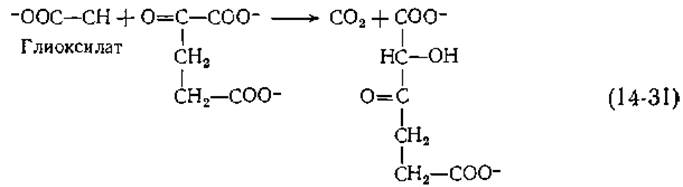
Хотя значение этой реакции неизвестно, легко видеть, что продукт может подвергаться дальнейшему декарбоксилированию и окислению с регенерацией а-кетоглутарата. Тем самым фермент обеспечивает наличие циклического пути окисления глиоксилата (тесно сопряженного с циклом дикарбоновых кислот; рис. 9-5), не зависящего от образования оксалата. Следует иметь в виду, что реакций, в которых наблюдается ферментативная конденсация глиоксилата, продемонстрировано множество н что метаболизм глиоксилата в большинстве организмов еще не вполне ясен.
Другой путь катаболизма используется в клетках Diplococcus glycinophilus, способных расти на глицине в качестве единственного источника энергии, углерода и азота [71]. Начальной реакцией является декарбоксилирование глицина с одновременным окислением под действием NAD+, освобождением аммиака и переносом а-углеродного атома глицина на тетрагидрофолиевую кислоту (H4Fоl), превращающуюся в метилентетрагидрофолиевую кислоту. В последнем соединении метиленовая группа, занимающая положение С-1, может конденсироваться с другой молекулой глицина [обращение реакции, описываемой уравнением (8-19)], образуя серин, который в свою очередь может превращаться в пируват [уравнение (14-32)]:
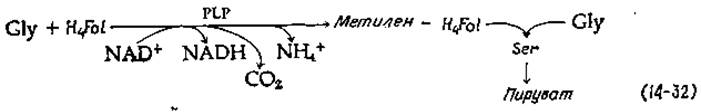
Пируват может быть окислен как источник энергии или использован для синтеза клеточных компонентов. Весь этот путь, по всей видимости, занимает важное место как в метаболизме растений и животных [72], так и в метаболизме бактерий.
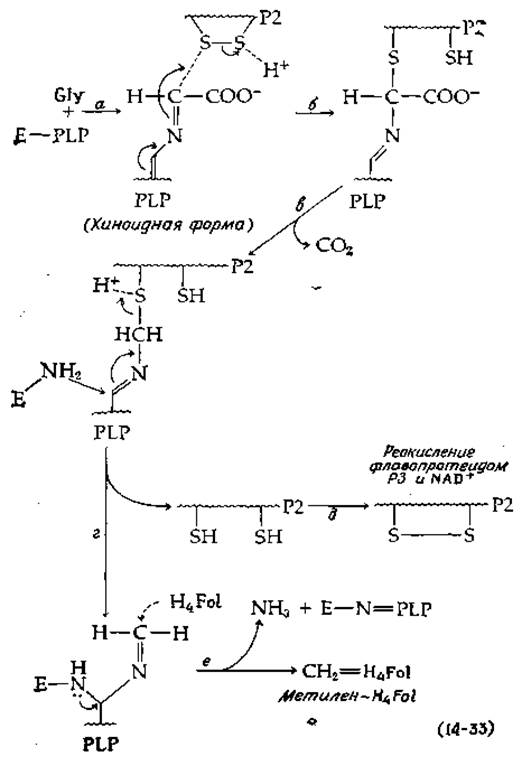
Стадия декарбоксидирования, показанная в уравнении 14-32, требует участия четырех белков, один из которых (Р1, мол. вес ~125 000) содержит две молекулы PLP и предположительно реагирует с глицином, образуя шиффово основание. Гипотетический механизм дальнейшего хода реакции [уравнение (14-33)] основан на предположениях, выдвинутых Багинским и Хюннеккенсом [73].
На стадии а, вероятно, происходит отщепление одного из а-водородов глицина и образуется хиноноидное промежуточное соединение, которое далее (на стадии б) реагирует с белком Р2, небольшой термоустойчив вой молекулой с мол. весом ~10 000, напоминающей тиоредоксин (гл. 8; разд. И, 2). После декарбоксилирования (стадия в) восстановленный Р2 освобождается (стадия г) и вновь окисляется на стадии д флавопротеидом Р3 (с мол. весом ~120 000, содержащим одну молекулу FAD). Восстановленный Р3 в свою очередь окисляется под действием NAD+.
От глицина, присоединенного к PLP в белке Р1, остаются всего лишь СН2-фрагмент и аминогруппа. Читатель легко сможет сам написать ряд реакций замещения и элиминирования, в ходе которых азот в 5-м положении (N-5) тетрагидрофолиевой кислоты (гл. 8, разд. Л, 1) акцентирует СН2-группу и одновременно с образованием внутреннего шиффова основания между PLP и ε-аминогруппой фермента (стадия е) происходит освобождение NH3. Роль белка Р4 неизвестна, но возможней что он участвует в переносе СН2-группы на тетрагидрофолиевую кислоту.