Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Метаболизм азотсодержащих соединений
Метаболизм ароматических соединений
Метаболизм фенилаланина и тирозина у животных и бактерий
На рис. 14-20 показаны основные катаболические пути, а также несколько реакций биосинтеза, составляющих метаболизм фенилаланина и тирозина в организме животных. Переаминирование с превращением в фенилпируват (реакция а) протекает довольно легко, и образующийся продукт может окислительно декарбоксилироваться, превращаясь в фенилацетат. Последний может быть выведен из организма в виде конъюгатов глутамина (вспомните эксперименты Кноопа, в которых у собак фенилацетат экскретировался после конъюгирования с глицином; дополнение 9-А). Этот путь разрушения фенилаланина реально существует и у человека, но, по-видимому, в ограниченной степени, поскольку, если избыток фенилаланина не окисляется в тирозин (реакция б, рис. 14-20), то он оказывает на человека токсическоее действие1).
Много внимания уделялось зависимому от птеридина гидроксилированию фенилаланина в тирозин [уравнение (10-52)], что частично объяснялось наличием такого тяжелого нарушения обмена, как фенилкетонурия [118], при которой этой реакции не происходит. Новорожденные с таким нарушением поначалу ничем не отличаются от здоровых детей, однако вскоре они начинают отставать в умственном развитии. Если поступление фенилаланина в организм такого ребенка ограничить до уровня, необходимого лишь для синтеза белков, то можно предотвратить развитие тяжелого дефекта. Некоторые дети на такой диете уже выросли до зрелого юношеского возраста без какого-либо отставания в умственном развитии, причем с возрастом у них повысилась переносимость фенилаланина.
а. Катаболизм тирозина
Основной путь разрушения тирозина в организме животных начинается реакцией переаминирования с превращением в «оксифенилпируват (рис. 14-20, реакция в). Фермент тирозинаминотрансфераза изучен довольно подробно, что объясняется индукцией его синтеза в печени в ответ на действие глюкокортикоидных гормонов (гл. 11, разд. Е, 7). Синтез этого фермента контролируется и на уровне трансляции [119], причем освобождение новообразованного белка из рибосом печени стимулируется циклическим АМР. Кроме того, этот фермент подвержен постранскрипционной модификации, включающей фосфорилирование [120], и характеризуется необычно быстрым оборотом [121].
Кетокислота n-оксифенилпируват декарбоксилируется под действием диоксигеназы, которая рассматривалась в гл. 10 [уравнение (10-55)]. Продукт реакции гомогентизиновая кислота подвергается действию второй диоксигеназы (рис. 14-20), превращаясь в конечном итоге в фумарат и ацетоацетат.
Одним из первых замеченных «врожденных нарушений метаболизма» была алкаптонурия — отсутствие оксигеназы, расщепляющей кольцо гомогентизиновой кислоты [122]. Заболевание легко распознать по следующему признаку: моча при стоянии приобретает темно-бурый цвет (что объясняется окислением гомогентизата). Алкаптонурия была правильно охарактеризована Гарродом (дополнение 1-Г) в 1909 г. как нарушение катаболизма тирозина.
б. Гормоны щитовидной железы [123, 124].
Гормоны щитовидной железы, основными и наиболее активными формами которых являются тироксин и трииодтиронин, образуются в результате метаболических превращений тирозина. Щитовидная железа богата иодид-ионами, которые активно поступают из плазмы и концентрируются до концентрации ~1 мкМ свободного I-. Под действием особой пероксидазы [см. уравнение (10-7) и относящийся к нему текст] иодид-ионы вступают в реакцию, приводящую к иодированию остатков тирозина в высокомолекулярном (димерном) белке тиреоглобулине (мол. вес 660 000) [124а]. Путем такого иодирования нескольких боковых цепей тирозина образуются остатки моно- и динодтирозина [ypaвнение (14-43)].
1) Однако механизм повреждающего действия избытка этой аминокислоты на мозг пока неизвестен.
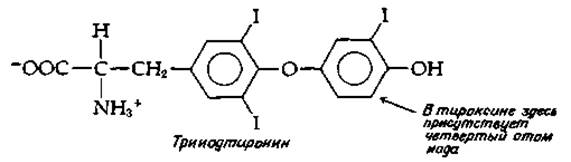
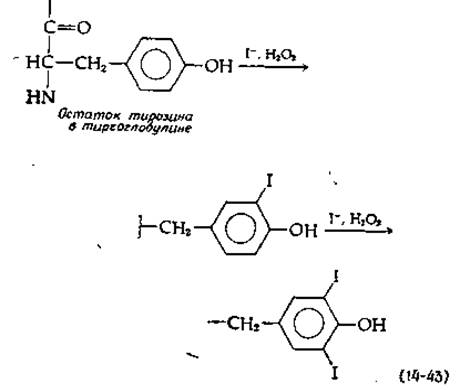
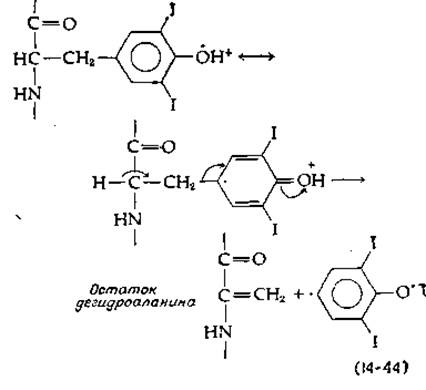
Природа реакции сопряжения колец, с помощью которой ароматическая группа одного остатка моно- или динодтирозина присоединяется эфирной связью ко второму такому остатку, пока не ясна. Известно однако, что реакция легко протекает в присутствии кислорода и пероксидазы. Нетрудно представить себе, что из иодированного тирозина образуется радикал с дефицитом электронов, который подвергается β-элиминированию с образованием дегидроаланина и ароматического радикала. Последний конденсируется со вторым радикалом, образуя трииодтиронин или тироксин [уравнение (14-44)]. Вторая возможность сводится к использованию пиридоксальфосфатзависимого β-элиминирования радикала. Третью возможность составляет окислительная атака на кетокислоты, получаемые из иодотирозинов [125].
Тироксины и трииодтиронин освобождаются из тиреоглобулина под действием ряда протеиназ. Как действие протеиназ, так и освобождение гормонов щитовидной железы в кровь стимулируется тиреотропным гормоном гипофиза (ТТГ). Этот тиреотропный гормон, подобно глюкагону, вероятно, использует в своем действии механизм, связанный с участием сАМР. Гормоны щитовидной железы разносятся по всему организму связывающим эти гормоны глобулином — специальным белком, выполняющим транспортную функцию. Некоторые молекулы гормонов переносятся и другими сывороточными белками. Как тироксин, так и трииодтиронин оказывают мощное гормональное воздействие на ткани, но для трииодтиронина лаг-период ответной реакции короче, чем для тироксина. В клетках-мишенях тироксин, по-видимому, сперва теряет один атом иода и превращается в более активную трииодформу.
Основной функцией тироксина и трииодтиронина является стимулирование энергетического метаболизма в других тканях. Уже давно установлено, что недостаток гормонов щитовидной железы приводит к понижению уровня основного обмена (гл. 3, разд. А, 5). Однако полностью удовлетворительной химической теории действия этих гормонов пока нет. Ларди и его сотрудники получили важные данные, показавшие, что тироксин разобщает окислительное фосфорилирование в изолированных митохондриях (гл. 10, разд. Д, 5). При сравнении митохондрий, выделенных из тканей животных, получавших избыточное количество тироксина, с митохондриями от контрольных животных оказалось, что в митохондриях опытных животных скорость переноса электронов выше, чем в контроле. Однако никакого или почти никакого изменения отношения P/О при этом не наблюдается. Таким образом, in vivo гормон может, по-видимому, повышать скорость переноса электронов, не снижая эффективности синтеза АТР. Согласно одной из гипотез, разобщение происходит избирательно лишь на одной из стадий фосфорилирования [126].
Некоторые исследователи полагают, что разобщение фосфорилирования представляет собой вторичный эффект гормонов щитовидной железы, а первичный эффект — это индукция набухания митохондрий, которое может привести к самым различным метаболическим последствиям.
Имеются данные, свидетельствующие о прямом действии трииодтиронина на транскрипцию генов [127]. Наблюдалось связывание этого гормона с одним из ядерных белков [127а]; он связывается также другими клеточными компонентами [127b]. Важное значение имеет способность трииодтиронина стимулировать мобилизацию жиров из жировой ткани. Высказывалось мнение, что этот эффект обусловлен ингибирующим действием гормонов щитовидной железы на связанную с мембраной фосфодиэстеразу циклического АМР [уравнение (7-25)] [128].
Известен целый ряд заболеваний щитовидной железы. Обычно они сопровождаются увеличением ее размеров (развивается зоб). Происходящие при этом нарушения могут затрагивать транспорт иода в щитовидную железу и образование иодированного тиреоглобулина. Они могут также проявляться в низкой эффективности конденсации ароматических колец с образованием иодированных остатков тиронина [124].
в. Катехоламины
Декарбоксилирование в сочетании с гидроксилированием цикла тирозина приводит к образованию производных о-диоксибензола (катехола), играющих важную роль в качестве нейромедиаторов. Они являются, кроме того, предшественниками меланина — черного пигмента кожи и волос. Один из путей образования катехоламинов проходит через декарбоксилирование тирозина в тирамин (рис. 14-20, реакция д) с последующим его окислением. Однако количественно преобладает другой путь — гидроксилирование под действием тирозингидроксилазы [129], зависящей от восстановленного птерина; в результате образуется 3,4-диоксифенилаланин, более известный под названием ДОФА. Это соединение получило широкую известность благодаря его терапевтическому эффекту при болезни Паркинсона. Сильное ослабление организма, сопутствующее этой болезни, рассматривается как результат отсутствия продукта декарбоксилирования ДОФА, дофамина (рис. 14-20), в некоторых участках мозга. Введение ДОФА в пищевой рацион приводит к более эффективному образованию дофамина в ткани мозга.
При гидроксилировании дофамина аскорбиновой кислотой в присутствии медьсодержащего фермента [уравнение (10-57)] образуется норадреналин (норэпинефрин). Последующее метилирование приводит к образованию важного гормона адреналина (эпинефрина). Имеются два основных пути катаболического разрушения катехоламинов. Они показаны на рис. 14-20 на примере адреналина. Моноаминооксидаза (МАО) вызывает окислительное расщепление, сопровождающееся дезаминированием. Последующее окислительное отщепление боковой цепи в сочетании с метилированием дает такие конечные продукты, как ванилиновая кислота, выделяемая с мочой. Второй катаболический путь состоит в непосредственном О-метилировании под действием катехоламин — О-метилтрансферазы (КОМТ), очень активного фермента, присутствующего в нервных тканях. Метаболиты почти не обладают какой-либо заметной физиологической активностью и могут экскретироваться как таковые или подвергаться дальнейшему окислительному распаду.
г. Меланины [730]
Диоксифенилаланин (ДОФА) в присутствии кислорода быстро темнеет. Процесс сильно ускоряется под действием тирозиназы (дополнение 10-3), катализирующей также окисление тирозина в ДОФА (рис. 14-20, реакция е). У животных тирозиназа обнаруживается только в органеллах, называемых меланосомами, которые находятся в меланоцитах — особых клетках, синтезирующих меланин. Пигменты образуются в результате последовательных реакций ферментативного и неферментативного окисления, декарбоксилирования и конденсации. Начальные стадии приведены на рис. 14-21. Вслед за окислением ДОФА в дофахинон происходит внутримолекулярная реакция присоединения в сочетании с таутомеризацией молекулы в производное индола — лейкодофахром. За вторым окислением под действием тирозиназы следуют декарбоксилирование и таутомеризация в 5,6-диоксииндол. Последний может подвергаться третьей реакции окисления в индол-5,6-хинон. В результате конденсации двух последних продуктов (как показано на рис. 14-21) образуется димер, к которому могут окислительным путем присоединяться дальнейшие диоксииндольные звенья с образованием в конечном итоге высокополимерного соединения. Родственная серия красных полимеров, присутствующих в рыжих волосах и перьях, образуется путем присоединения цистеина к дофахинону [131]. Присоединение цистеина может происходить по нескольким положениям. Образующиеся в результате аддукты (показан лишь один) могут подвергаться окислительной циклизации, как указано на приведенном рисунке.
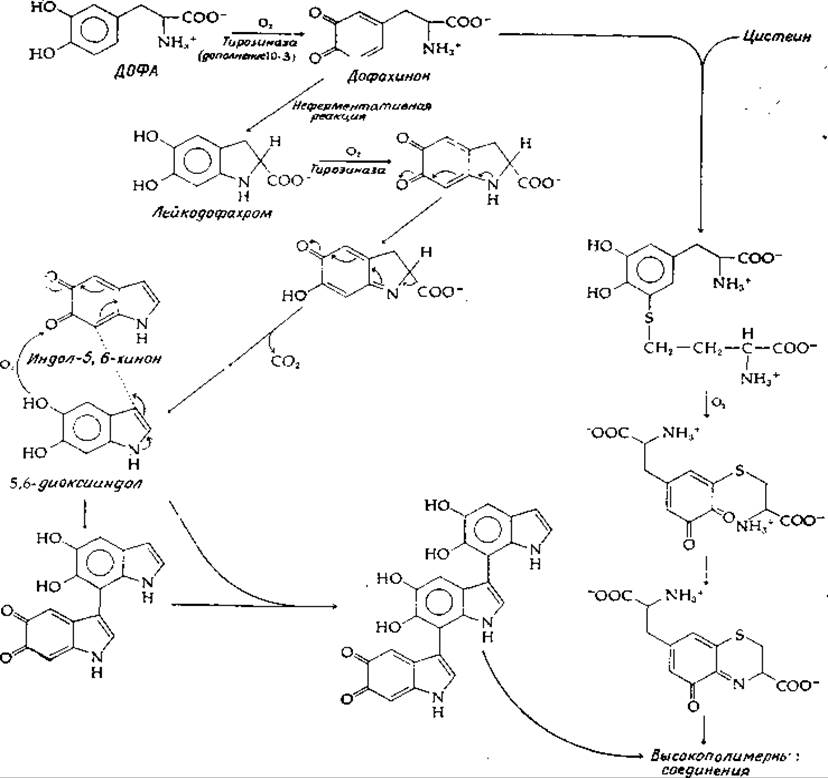
РИС. 14-21. Некоторые предполагаемые пути синтеза черного пигмента меланина и пигментов рыжих волос и перьев.
д. Катаболизм фенилаланина, тирозина и других бензоидных соединений у бактерий
Бактерии играют в биосфере важную роль, разрушая многие ароматические соединения, образующиеся в результате метаболических превращений у растений [132]. К последним относится лигнин, главный компонент древесины и один из наиболее распространенных растительных продуктов, количественно уступающий лишь целлюлозе.
В некоторых случаях разрушение ароматических соединений бактериальной клеткой начинается с реакций элиминирования. Так, у некоторых бактерий в результате ß-элиминирования из тирозина освобождается фенол. Чаще наблюдается гидроксилирование и окислительное разрушение боковых цепей, ведущее к образованию производных бензойной кислоты или к различным оксибензойным кислотам [133]. Несколько примеров приведено на рис. 14-22. Обратите внимание, что в каждом случае для раскрытия бензольного кольца необходима та или иная диоксигеназа. Эти пути проходят через интересные стадии изомеризации [134]; некоторые из них уже обсуждались на предыдущих страницах.
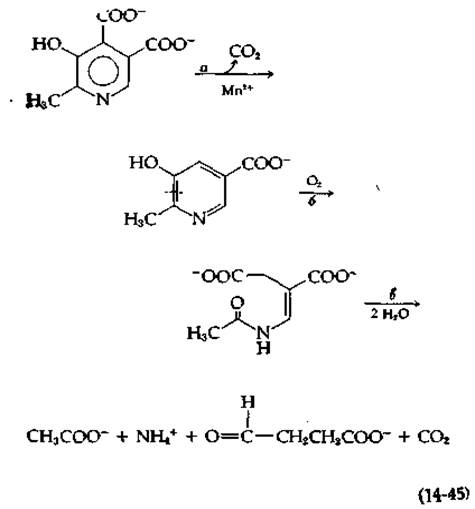
Заслуживает упоминания еще один пример разрушения ароматических соединений, поскольку при этом протекают необычные ферментативные реакции. Имеется в виду разрушение бактериями различный форм витамина В6 [136]. В случае одного из путей первые стадии заключаются в окислении оксиметильной группы в 5-м положении и замещающей группы в 4-м положении с превращением их в карбоксилатные группы. Затем, как показано в уравнении (14-45), происходит декарбоксилирование под действием необычной диоксигеназы.
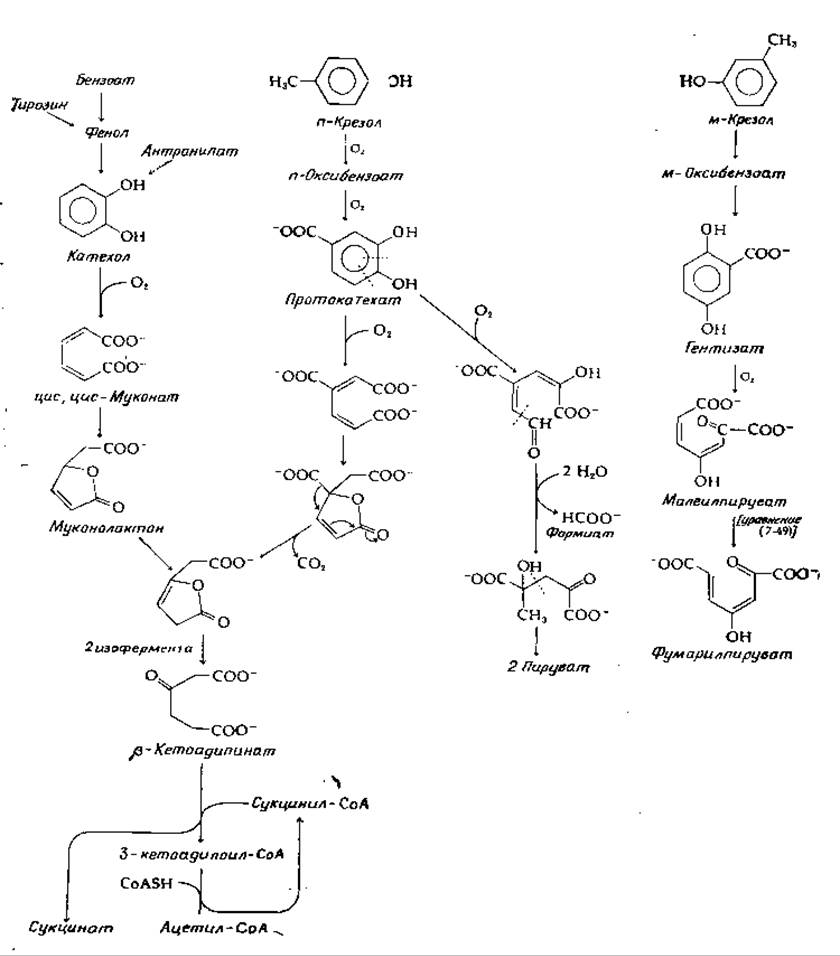
РИС. 14-22. Несколько примеров катаболизма ароматических соединений у бактерий.
Эта диоксигеназа, выделенная из одного штамма Pseudomonas, содержит связанный FAD, который должен восстанавливаться под действием внешнего NADH. Фермент, подобно типичной диоксигеназе, вводит в продукт два атома кислорода. Однако он также использует восстановленный FAD для восстановления системы двойных связей (либо до, либо после атаки молекулярным кислородом). Другой фермент тех же бактерий примечателен тем, что гидролитически разлагает продукт реакции оксигенации на четыре различных соединения без накопления промежуточных соединений.