Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Как возникла настоящая концепции
ДНК как генетический материал
Открытие дезоксирибонуклеиновой кислоты датируется 1869 г., когда Фредерик Мишер выделил новое химическое соединение из лейкоцитов (из гноя), а затем и из сперматозоидов. Это вещество получило название нуклеиновой кислоты. Спустя некоторое время выяснилось, что оно встречается как у растений, так и у животных, причем оказалось, что к лучшим источникам нуклеиновых кислот относятся тимус и дрожжевые клетки. В результате химических исследований вскоре было установлено, что нуклеиновые кислоты, выделенные из тимуса и из дрожжей, различны. Как мы теперь знаем, тимусные нуклеиновые кислоты представлены в основном ДНК, а дрожжевые — РНК. В течение некоторого времени полагали, что в клетках животных содержится только ДНК, а в клетках растений — только РНК; так думали до начала 40-х годов, когда стало ясно, что во всех живых организмах содержатся оба соединения [5, б].
с. «Трансформация» бактерий
В 1928 г. на клетках Diplococcus pneumoniae были выполнены важные эксперименты, результаты которых показали, что генетическая информация, контролирующая свойства капсульных полисахаридов (гл. 5, разд. Г), может передаваться от одного штамма бактерий к другому, «Согласно этим экспериментам, какое-то вещество, присутствующее в убитых клетках и бесклеточных экстрактах, стабильно изменяет свойства капсул, подвергнутых воздействию этого вещества. Данное явление, подучившее название «трансформация» бактерий, много лет оставалось загадкой. В то время когда были выполнены эти эксперименты, не было даже и намека на генетическую роль нуклеиновых кислот, которые воспринимались всеми как довольно странный материал. Более того, к тому времени еще не была доказана ковалентная природа связей в нуклеиновых кислотах. Широко было принято представление о тетрануклеотиде как о повторяющейся единице какого-то регулярного полимера. Обычно считалось, что гены имеют белковую природу.
В 1944 г. Эйвери1) и его сотрудники показали, что очищенные экстракты ДНК пневмококков могут вызвать трансформацию бактерий [7, 8]. Очищенный трансформирующий агент содержал лишь небольшое количество белков. Протеолитические ферменты его не инактивировали, а дезоксирибонуклеаза — инактивировала.
Таким образом, эксперименты по трансформации бактерий убедительно показали, что ДНК является генетическим материалом. На это указывали также результаты некоторых других экспериментов. Было обнаружено, например, что ДНК локализуется в ядрах эукариотических клеток. Оказалось, что абсолютное количество ДНК в расчете на одну клетку для организма данного вида — величина постоянная. Тот факт, что ДНК представляет собой генетический материал определенных вирусов, доказали в 1952 г. Д. Херши и Чейз [8а], обнаружившие, что при заражении клетки вирусом бактерий (бактериофагом) вирусная ДНК проникает внутрь бактерии, а белковая «оболочка» остается снаружи. Это удалось продемонстрировать, приготовив два типа меченых бактериофагов Т2 (дополнение 4-Д). В одном из них ДНК была мечена изотопом 32Р, а у другого в белок был включен изотоп 35S. Клетки Е. coli заражали препаратами меченых фагов, а затем энергично перемешивали в гомогенизаторе Уоринга для удаления фаговых частиц. В результате произошло следующее: около 80% 35S отделилось от бактерии, большая же часть 32Р проникала внутрь бактерий и могла быть обнаружена даже в бактериофагах следующих поколений [3].
1) Чаргаф указывает, что, сделав это открытие в возрасте 67 лет, Эйвери опроверг широко распространенную точку зрения, согласно которой научные открытия делаются только молодыми людьми.
б. Двойная спираль [9]
По мере развития новых методов исследования химического состава нуклеиновых кислот было установлено (Чаргафом), что, несмотря на очень сильное различие в относительном содержании разных оснований в различных ДНК, молярное соотношение между аденином и тимином, так же как и между цитозином и гуанином, во всех исследованных ДНК составляет приблизительно 1 : 1 [10]. На основе этих данных была выдвинута концепция о спаривании оснований в ДНК. Окончательные результаты были получены при исследовании вытянутых нитей ДНК методом реитгеноструктурного анализа. Из этих исследований следовало, что молекулы ДНК почти наверняка имеют строение спирали, состоящей более чем из одной цепи. Решающие эксперименты были выполнены Франклин [11] и Уилкинсом, данные которых использовали Уотсон и Крик при построении в 1953 г. своей модели двойной спирали [12, 13] (рис. 2-21). Когда строение ДНК было установлено, оно уже само по себе подсказывало вывод о кодирующих свойствах молекулы ДНК и о механизме ее репликации в природе. Казалось очевидным, что основой генетического кода должна служить последовательность нуклеотидов и что спаривание оснований представляет собой механизм, делающий возможным разделение двух взаимно комплементарных цепей и последующий биосинтез новой комплементарной цепи (вдоль каждой из родительских цепей). Таким способом может происходить точное копирование генов. Аналогично этому молекулы РНК могут синтезироваться вдоль ДНК-«матрицы», а затем выходить в цитоплазму.
Связь между наличием РНК в цитоплазме и синтезом белка была установлена благодаря результатам ряда опытов, выполненных в начале 40-х годов [т. е. до того как была расшифрована структура ДНК — Перев.]. Вслед за открытием двойной спирали сразу же была предложена концепция, согласно которой ДНК играет роль первичного «шаблона», с которого могут копироваться вторичные шаблоны РНК. РНК-копии, впоследствии получившие название информационных РНК (мРНК; гл. 1, разд. А, 4), содержат генетическую информацию, определяющую последовательность аминокислот в белке. Поток информации от ДНК к РНК и к белку может быть символически представлен в следующем виде:
![]()
Белки тем или иным образом контролируют все метаболические процессы, в том числе реакции образования нуклеотидных предшественников нуклеиновых кислот и реакции, приводящие к полимеризации аминокислот и нуклеотидов. Таким образом, поток информации от ДНК к белкам представляет собой лишь часть большей петли метаболических процессов, причем сам процесс репликации ДНК происходит с высокой степенью точности. Поток генетической информации всегда направлен от ДНК в клетку, и копии с первичного шаблона передаются от поколения к поколению почти в неизменном виде. Простая концепция, выраженная уравнением (15-1), быстро привлекла к себе внимание ученого мира и привела к стремительному развитию биохимической генетики.
в. Хромосомная карта Е. coli
Рассмотрим теперь наиболее важный аспект строения ДНК, а именно последовательность нуклеотидов, в которой и заключена генетическая информация. В кольцевой молекуле ДНК, образующей хромосому Е. coli, содержится 3,8 млн. нуклеотидов. В сущности говоря, мы еще только приступили к детальному изучению нуклеотидной последовательности некоторых участков этой хромосомы. Однако если иметь в виду не детали, то можно сказать, что о хромосоме мы знаем не так уж мало. Точно известно, в частности, что индивидуальные гены в этой хромосоме расположены линейно. К 1972 г. было установлено расположение 460 генов на хромосомной карте (рис. 15-1; см. также табл. 15-1).
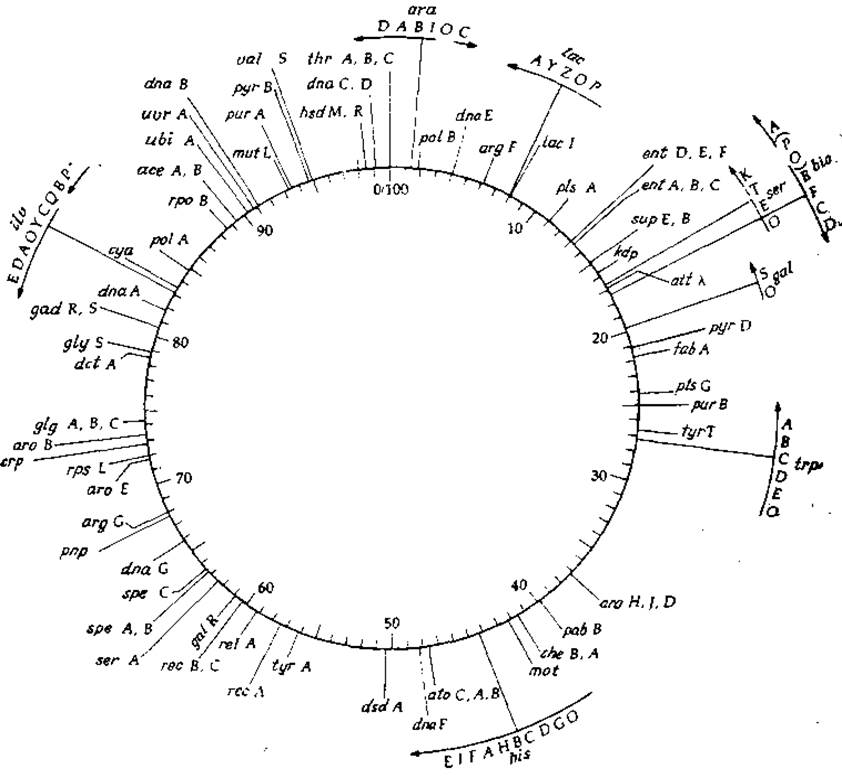
РИС. 15-1. Хромосомная карта Е. coli штамма К-12 (данные взяты из статьи Bachman В. J., Low К. В., Taylor A. L., Bacteriol. Rev., 40, 116—167 (1976)). Шкала времени построена по результатам опытов с прерванной конъюгацией. Точкой отсчета произвольно выбран локус thr. Перечень генетических символов и пояснення к ним приведены в табл. 15-1. В каждом данном участке генома обычно транскрибируется только одна из цепей ДНК. Поскольку цепи ДНК аитипараллельны, то при транскрипции одна из цепей считывается по часовой стрелке, а другая — в противоположном направлении (условно принято считать, что при указанной на рисунке ориентации хромосомы r-цепь транскрибируется по часовой стрелке). Направления транскрипции различных оперонов указаны стрелками. Аналогичными методами была получена также карта для Salmonella typhimurium [Sanderson К. Е., Bacteriol. Rev., 36, 558—586 (1972)].
Для того чтобы стало понятно, как была получена приведенная на рис. 15-1 хромосомная карта, необходимо вкратце рассмотреть некоторые из методов генетических исследований. (К этому вопросу мы еще вернемся в разд. Б.) Первые работы по составлению генетических карт относятся к тому времени, когда было обнаружено, что существуют мутанты, рост которых зависит от присутствия в среде специфических факторов. Обычные клетки Е. coli «дикого типа» могут расти на минимальной среде, содержащей какое-либо углеродное соединение в качестве источника энергии и неорганические питательные вещества. Ультрафиолетовое облучение или обработка химическими мутагенами приводит к. появлению большого числа мутантных клеток, неспособных расти на такой минимальной среде. Однако при добавлении одного или нескольких специфических соединений типа аминокислот или витаминов рост мутантных бактерий обычно восстанавливается. Отбор ауксотрофов по пищевым потребностям (так называются эти мутанты) чаще всего осуществляют, высевая большое число облученных или химически обработанных клеток в чашки, содержащие твердую, богатую питательными веществами среду. Затем, когда из отдельных бактерий образуются колонии (клоны), производят отбор ауксотрофов методом реплик (отпечатков), пересевая отпечатки (реплики) полученных колоний в чашки, содержащие минимальную среду со специфическими добавками1).
Таблица 15-1 Некоторые гены Е. coliа
|
Символ гена |
Происхождение символа |
Положение на генетической карте, минб |
Другие генетические символы; кодируемый признак |
|
асеА |
Ацетат |
89 |
Изоцитрат-лиаза |
|
асеВ |
89 |
Малат-синтетаза А |
|
|
аrаА |
Арабиноза |
1 1 |
L-арабинозонзомераза |
|
аrаВ |
L-рнбулокиназа |
||
|
аrаС |
1 |
Регуляторный ген |
|
|
araD |
1 |
L-рибулозо-5-фосфат — 4-эпимераза |
|
|
araI |
1 |
Инициаторный локус |
|
|
araO |
1 |
Операторный локус |
|
|
argF |
Аргинин |
6 |
Орнитин-карбамоилтрансфераза |
|
argG |
68 |
Аргининосукцинат-синтетаза |
|
|
aroB |
Ароматический |
73 |
Дегидрохнинат-синтетаза |
|
aroD |
37 |
Дегидрохиннат-дегидратаза |
|
|
aroE |
71 |
Дегидрошикиматредуктаза |
|
|
aroH |
37 |
6-фосфат-3-дезоксн-D-арабиногептулонат — синтетаза (изофермент, репрессируемый триптофаном) |
|
|
aroJ |
Ароматический |
37 |
Возможный локус оператора для аrоН |
|
atoA |
Ацетоацетат |
48 |
СоА-трансфераза |
|
atoB |
48 |
Тиолаза II |
|
|
atoC |
» |
48 |
Регуляторный ген |
|
att λ |
Присоединение (attachment) |
17 |
Сайт интеграции профага λ |
|
biоА |
Биотин |
17 |
Группа II; 7-оксо-8-аминопеларгоновая кислота (7 КАР)7,8-диаминопеларгоновая кислота (DAPA) |
|
bioB |
» |
17 |
Превращение детиобиотина в биотин |
|
bioC |
17 |
Блок на одной из стадий предшествующих синтезу пимелоил-СоА |
|
|
bioD |
17 |
Детиобнотин-синтетаза |
|
|
bioF |
17 |
Пнмелоил-СоА→7 КАР |
|
|
bioO |
» |
17 |
Оператор для генов от biоВ до bioD |
|
bioP |
17 |
Промотор для генов от biоВ до BioD |
|
|
cheA |
Хемотаксис |
42 |
Хемотакснческая подвижность |
|
cheB |
» |
42 |
То же |
|
crp |
73 |
Белок-рецептор циклического аденозинмонофосфата |
|
|
cya |
83 |
Аденилатциклаза |
|
|
dctA |
79 |
Поглощение С4-дикарбоновых кислот |
|
|
dnaA |
ДНК (DNA) |
82 |
Синтез ДНК, нарушение инициации |
|
dnaB |
91 |
Синтез ДНК |
|
|
dnaC |
99 |
dnaD; синтез ДНК, нарушение инициации |
|
|
dnaE |
4 |
polC; ДНК-полимераза III и активность мутатора |
|
|
dnaF |
48 |
nrdA; рибонуклеозиддифосфат-редуктаза |
|
|
dnaG |
» |
66 |
Синтез ДНК |
|
dsdA |
D-серин |
50 |
Дезаминаза D-серина |
|
entA |
Энтерохелин |
13 |
2,3-дигидро-2,3-диоксибензоат — дегидрогеназа |
|
entB |
» |
13 |
2,3-дигидро-2,3-диоксибензоат — синтетаза |
|
entC |
» |
13 |
Изохоризмат-синтетаза |
|
entD, E, F |
» |
13 |
Неизвестные стадии превращения 2,3-диоксибензоата в энтерохелин |
|
fabA |
22 |
ß-Оксидеканоилтиоэфир — дегидратаза |
|
|
gadR |
81 |
Регуляторный ген для gadS |
|
|
gadS |
81 |
Глутаматдекарбоксилаза |
|
|
galE |
Галактоза |
17 |
Уридиндифосфогалактоза — 4-эпимераза |
|
galK |
» |
17 |
Галактокиназа |
|
galO |
» |
17 |
Локус оператора |
|
gаlТ |
17 |
Галактоза-1-фосфат — уридилтрансфераза |
|
|
galR glgA glgB |
» |
61 |
Регуляторный ген |
|
Гликоген |
74 |
Гликогенсинтетаза |
|
|
» |
74 |
а-1,4-глюкан : а-1,4-глюкан — 6-глюкозилтрансфераза |
|
|
glgC |
» |
74 |
Аденозиндифосфат : глюкоза — пирофософорилаза |
|
glyS hisA |
Глицин |
79 |
Глицил-тРНК — синтетаза |
|
Гистидин |
44 |
Изомераза |
|
|
hisB |
» |
44 |
Имидазолглицефосфат-дегидратаза, гистидинолфосфатаза |
|
hisC |
» |
44 |
Имидазолацетолфосфат-трансаминаза |
|
hisD |
» |
44 |
Гистидинолдегидрогеназа |
|
hisE |
» |
44 |
Фосфорибозил-АТР — пирофосфогидролаза |
|
hisF |
» |
44 |
Циклаза |
|
hisG |
» |
44 |
Фосфорибозил-АТР — пирофосфорилаза |
|
hisH |
Гистидин |
44 |
Амидотрансфераза |
|
hisI |
» |
44 |
Фосфорибозил-АМР — гидролаза |
|
hisO |
» |
44 |
Локус оператора |
|
hsdM |
Зависимость от специфического хозяина (host specifify) |
98 |
Модификация ДНК хозяина: ДНК-метилаза М |
|
hsdR |
То же |
98 |
Рестрикция ДНК хозяина: эндонуклеаза R |
|
ilvA |
Изолейцин-валин |
83 |
Треониндезаминаза (дегидратаза) |
|
ilvB |
» |
83 |
Синтетаза I ацетооксикислот |
|
ilvC |
» |
83 |
Редуктоизомераза а-окси-β-кислот |
|
ilvD |
» |
83 |
Дегидраза |
|
ilvE |
» |
83 |
Трансаминаза В |
|
ilvO |
» |
83 |
Локус оператора для генов ilvA, D, Е |
|
ilvP |
83 |
Локус оператора для гена ilvB |
|
|
ilvQ |
» |
83 |
Индукция узнающего участка гена ilvC |
|
ilvcY |
» |
83 |
Элемент положительного контроля индукции гена ilvC |
|
kdp |
Зависимость от калия (K-dependence) |
16 |
Дефект в поглощении ионов К |
|
lacA |
Лактоза |
8 |
Тиогалактозид-трансацетилаза |
|
lacI |
» |
8 |
Регуляторный ген |
|
lacO |
8 |
Локус оператора |
|
|
lacP |
8 |
Локус промотора |
|
|
lacY |
» |
8 |
Галактозид-пермеаза (М-белок) |
|
lacZ |
» |
8 |
ß-Галактозидаза |
|
mot |
Подвижность (motility) |
42 |
Паралич жгутиков |
|
mutL |
Мутатор |
93 |
Высокая степень генерализованной мутабильности (AT⇄GC) |
|
pabB |
n-Амииобензоат |
40 |
Потребность в n-аминобензоате |
|
pii |
Пили |
98 |
Наличие или отсутствие пилей (ворсинок) |
|
plsA pop |
Фосфолипид |
11 68 |
Глицерол-3-фосфат— ацилтрансфераза Полинуклеотидфосфорилаза |
|
polA |
Полимераза |
85 |
ДНК-полимераза I |
|
polB |
2 |
ДНК-полимераза II |
|
|
pisG |
Система фосфотрансферазы |
24 |
Катаболитная репрессия |
|
purA |
Пурин |
93 |
Аденилосукцинат-синтетаза |
|
purB |
» |
25 |
Аденилосукциназа |
|
pyrB |
Пиримидин |
95 |
Аспартат-карбомоилтрансфераза |
|
pyrD |
» |
21 |
Дигидрооротатдегидрогеназа |
|
recА |
Рекомбинация |
58 |
Чувствительность к ультрафиолету и способность к генетической рекомбинации |
|
rесВ |
» |
60 |
Чувствительность к ультрафиолету, генетическая рекомбинация; субъединица экзонуклеазы V |
|
rесС |
» |
60 |
То же |
|
relA |
Ослабленный (relaxed) |
59 |
Регуляция синтеза РНК |
|
rроВ |
РНК-полимераза |
89 |
РНК-полимераза; ß-субъединица (rif-ген) |
|
rpsL |
Рибосомный белок, малый (ribosomal protein small) |
72 |
Рибосомный белок S12 (ген strA, устойчивость к стрептомицину) |
|
serА |
Серин |
62 |
3-фосфоглицерат — дегидрогеназа |
|
serО |
» |
20 |
Локус оператора |
|
serS |
» |
20 |
Серил-тРНК — синтетаза |
|
speA |
Спермидин |
63 |
Аргининдекарбоксилаза |
|
speB |
» |
63 |
Агматин — уреогидролаза |
|
speC |
» |
63 |
Орнитиндекарбоксилаза |
|
supB |
Супрессор |
15 |
Супрессия оchrе-мутаций |
|
supE |
» |
15 |
Супрессия amber-мутаций (sti-2) |
|
thrA |
Треонин |
0 |
Комплекс аспартаткиназа — 1-гомосериндегидрогеназа I |
|
thrB |
» |
0 |
Гомосеринкиназа |
|
thrC |
» |
0 |
Треонинсинтетаза |
|
trpA |
Триптофан |
27 |
Триптофансинтетаза, А-белок |
|
trpB |
27 |
Триптофансинтетаза, В-белок |
|
|
trpC |
27 |
N- (5-фосфорибозил) -антранилат |
|
|
trpD |
» |
27 |
Фосфорибозил-антранилат — транс-фераза |
|
trpE |
27 |
Антранилат-синтетаза |
|
|
trpO |
» |
27 |
Локус оператора |
|
tyrA |
Тирозин |
56 |
Хоризматмутаза, Т-префенат — дегидрогеназа |
|
tyrT |
27 |
Тирозиновая тРНКі (ген su-3, amber-супрессор) |
|
|
ubiA |
Убихинон |
90 |
4-оксибеизоат→3-октапреиил-4-оксибензоат |
|
uvrA |
Ультрафиолет |
91 |
Репарация ультрафиолетовых повреждений ДНК, УФ-эндонуклеаза |
|
valS |
Валин |
95 |
Валил-тРНК — синтетаза |
а В этом списке приведено лишь 125 из 650 генов, положение которых на генетической карте установлено.
б Положення генов схематически показаны на рис. 15-1.
1) Для перепечатывания реплик к чашке с питательным агаром, на котором растут небольшие колонии бактерий, прижимают стерильную бархатную подушечку, после чего ее используют для «перепечатывания» реплик в чашки с минимальной средой. Исходные колонии и колонии, образовавшиеся в чашках-репликах (с минимальной средой), сравнивают, после чего отбирают колонии ауксотрофов (которые не росли на минимальной среде). На втором этапе ауксотрофы можно тем же методом реплик перенести в чашки с минимальной средой, содержащей различные питательные добавки (аминокислоты, пурины, пиримидины, витамины и т. д.). Отбор становится проще при предварительной обработке пенициллином (дополнение 7-Г) облученных клеток в минимальной среде. Пенициллин убивает растущие клетки, тогда как ауксотрофы, которые не растут на минимальной среде, выживают. В дальнейшем производят разрушение пенициллина, добавляя пенициллиназу (дополнение 7-Г). В результате этих операций процентное содержание ауксотрофных мутантов в суспензии значительно увеличивается [3].
У ауксотрофа по пищевым потребностям имеется обычно дефектный ген, детерминирующий белок, без которого не может осуществляться биосинтез питательного компонента, необходимого данному ауксотрофу. Исходя из этого, выявляют затронутый мутацией ген, которому присваивают соответствующий генетический символ. Так, например, ген, детерминирующий синтез одной из белковых субъединиц триптофансинтетазы, назван trpA. С помощью метода реплик можно определить также и другие типы мутаций, например мутации, нарушающие подвижность или другие свойства клетки; и в этом случае мутантные гены получают соответствующие символы. Некоторые из этих генетических символов приведены на генетической карте, показанной на рис. 15-1.
Обычно бактерии размножаются простым клеточным делением, т. е. количество ДНК в хромосоме удваивается, клетки делятся и дочерние клетки получают идентичные хромосомы. Однако, как показали в 1946 г. Ледерберг и Татум [13а], бактерии могут размножаться и половым путем. Прямых данных о спаривании у бактерий первоначально не было, однако было показано, что если смешать клетки двух различных мутантных штаммов К-12 Е. coli и выращивать их совместно в течение нескольких поколений, то некоторые бактерии вновь обретут способность к росту на минимальной среде. Поскольку каждый из этих штаммов содержал по одному дефектному гену, образование особи, не несущей ни одного из этих дефектов, могло произойти лишь в результате комбинирования генетического материала обеих штаммов. Именно эти опыты послужили основанием для вывода о существовании у бактерий конъюгации. В дальнейшем было показано, что в процессе конъюгации может происходить истинная генетическая рекомбинация. Это означает, что гены двух спаривающихся клеток могут быть интегрированы с образованием единой цепи бактериальной ДНК.
г. Факторы пола у бактерий
Сейчас мы знаем, что некоторые клетки E.coli штамма К-12 содержат небольшие дополнительные фрагменты ДНК, играющие роль фактора пола (фактор F, фактор плодовитости). Присутствие фактора F в бактериальной клетке как бы определяет ее принадлежность к мужскому полу. В числе прочих элементов фактор F содержит гены, необходимые для синтеза F-пилей (половых ворсинок). Эти тонкие отростки диаметром 8,5 нм вырастают быстро — в течение 4—5 мин они достигают длины, равной приблизительно 1,1 мкМ (см. также гл. 1, разд. А, 6; рис. 4-7). Конец F-пили присоединяется к женской клетке. Бринтон[14] Высказал предположение, что через пили ДНК может переходить из Мужской клетки в женскую0. Некоторым исследователям действительно удавалось наблюдать цитоплазматические мостики между тесно соприкасающимися клетками, однако истинный механизм переноса ДНК пока еще не выяснен.
Большое значение фактора F для картирования хромосом определяется тем обстоятельством, что изредка он интегрируется с бактериальной хромосомой. С помощью прямой электронной микроскопии было показано, что и хромосома, и фактор F имеют кольцевое строение. Для Их интеграции обязательно должно произойти ферментативное расщепление как ДНК хромосомы, так и ДНК фактора F с последующим воссоединением концов таким образом, чтобы образовалось непрерывное кольцо (рис. 15-2). Специальные ферменты, катализирующие эти реакции, рассматриваются далее в разд. Ж. Разные факторы F могут включаться в хромосому в различных местах. Штаммы бактерий, содержащих интегрированный фактор F, обозначают символом Hfr-штамм (от англ. high frequency of recombination — высокая частота рекомбинаций).
1) Не ясным остается, однако, вопрос о том, имеют ли F-пили форму трубочек с внутренним диаметром около 2,5 нм (рис: 4-7) или же для них характерна более открытая структура.
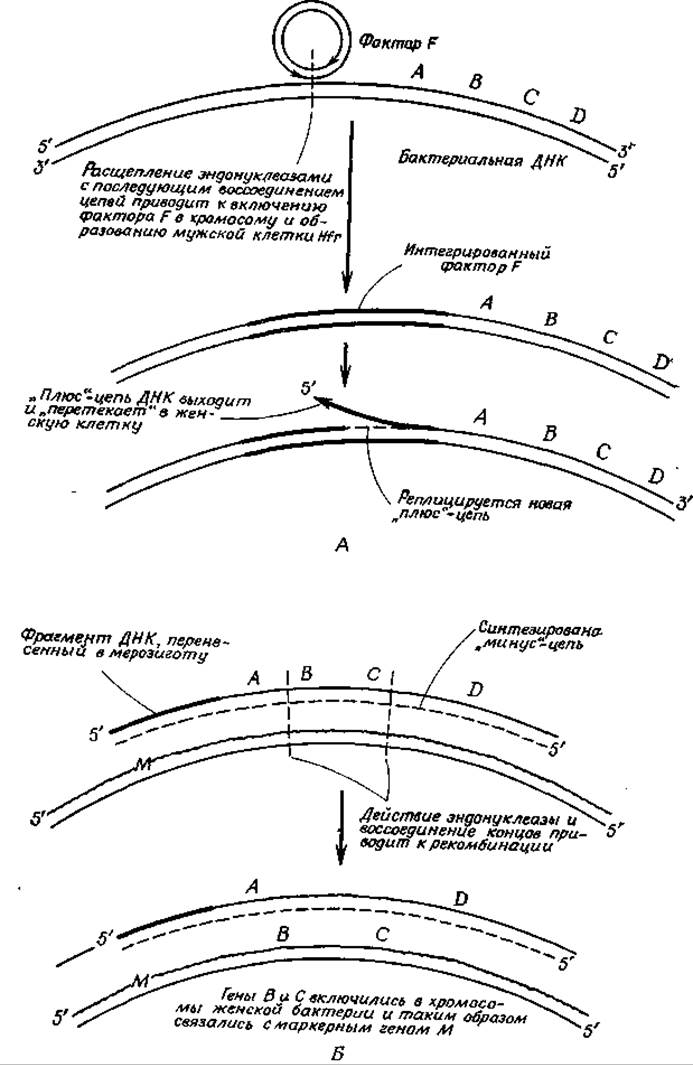
РИС. 15-2. Интеграция фактора F с бактериальной хромосомой и перенос некоторых; бактериальных генов в другую клетку. А. Включение фактора F в геном Е. coli и перенос «плюс»-цепи ДНК в женскую клетку-реципиент. Б. Генетическая рекомбинация между фрагментом перенесенной ДНК и геномом клетки-реципиента.
При конъюгации бактерии Hfr-штамма с бактерией F- (женской) происходит следующее: в какой-то точке, расположенной близко от конца интегрированного фактора F, хромосома начинает реплицироваться и бактериальные гены, а вслед за ними и гены фактора F переносятся в женскую клетку. Согласно существующим представлениям, из клетки- донора в клетку-реципиент переходит (возможно, через F-ворсинку) лишь одна из цепей ДНК, обычно обозначаемая как «плюс»-цепь (рис. 15-2). В клетке-реципиенте синтезируется комплементарная «минус»-цепь, в результате чего образуется двухцепочечная молекула ДНК, несущая гены из Hfr-клетки. Только в редких случаях «плюс»-цепь донорной клетки переходит в женскую клетку полностью. Чаще всего цепь ДНК или сама ворсинка разрываются, и происходит перенос лишь части хромосомы.
Частичный перенос хромосомы из мужской клетки приводит к тому, что F--клетка становится частично диплоидной (мерозигота), т. е. содержащей двойной набор многих генов. В такой частично диплоидной клетке между двумя хромосомами происходит обмен генетической информацией (генетическая рекомбинация) (рис. 15-2). Химические реакции, лежащие в основе этого процесса, имеющего важное значение для всех организмов, размножающихся половым путем, мы рассмотрим в разд. Ж. В конечном счете рекомбинационный процесс приводит к тому, что дочерние клетки, образовавшиеся при последующем делении, содержат только одну хромосому с обычным числом генов. Однако некоторые гены попадают в эту хромосому от каждого из родительских штаммов. Таким образом, может случиться, что клетка F-мутантного штамма, неспособная расти на среде без определенных питательных добавок, получит ген из мужской клетки, который позволит ей расти на минимальной среде. Хотя число таких рекомбинантных бактерий мало, тем не менее их легко можно отобрать из очень большого числа исходно смешанных мутантных бактерий.
д. Картирование хромосом методом прерванной конъюгации
Хромосомную карту E.coli можно получить, если смешать клетки Hfr и F- и дать возможность конъюгации происходить в течение определенного интервала времени, а затем клетки интенсивно перемешать, например, в гомогенизаторе Уоринга. В результате этой процедуры все конъюгационные мостики разрушаются и процесс спаривания бактерий прерывается. Спаривание прерывают через разные промежутки времени и определяют наличие в бактериях-реципиентах генов, перенесенных из клеток донорного штамма. При помощи этого метода было показано, что для полного переноса хромосомы при 37 °С требуется приблизительно 100 мин и что локализацию любого гена в хромосоме можно приблизительно установить по времени, необходимому для переноса этого гена в клетку-реципиент. В действительности, однако, все выглядит несколько сложнее. Поскольку полный перенос всей хромосомы осуществляется редко, в опытах обычно используются разные подштаммы Е. coli К-12, y которых фактор F расположен в разных местах; во всех случаях гены, вокализованные по часовой стрелке1) сразу же за точкой интеграции (Рис. 15-1), переносятся быстро и с высокой частотой.
При построении карты, приведенной на рис. 15-1, были использованы не только результаты опытов с прерыванием конъюгации, но и данные, полученные при изучении трансдукции бактериофагом Р1 [15]. Трансдукция фагом, более детально рассмотренная в разд. Г, позволяет переносить короткие фрагменты ДНК длиной около 2 мин (см. карту
E. coli). Совместная трансдукция, например одновременное включение двух генов в хромосому клетки-реципиента, осуществляется с частотой, коррелирующей с расстоянием между этими двумя генами на карте. Таким путем было произведено уточненное картирование многих участков хромосомы Е. coli.
Следует иметь в виду, что, хотя карта, приведенная на рис. 15-1, прокалибрирована в минутах, в недалеком будущем генетическую карту удастся, вероятно, представить непосредственно в микрометрах длины ДНК (общая ее длина составляет приблизительно 1100 мкМ) или в тысячах нуклеотидных единиц, называемых часто килобазами (кb). Общая длина ДНК составляет приблизительно 3800 кb1).
1) В случае F-фактора одного типа. Другие включаются в противоположном набавлении.