Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Как возникла настоящая концепции
Репликация ДНК
Методом микроспектрофотометрии было установлено, что перед делением клетки количество ДНК в ней удваивается. Было ясно, что обе дочерние клетки должны получать одну или большее число идентичных молекул ДНК. Не ясным оставался, однако, вопрос о том, копируется ли исходная двухцепочечная молекула ДНК таким способом, что сразу образуется новая целая двухцепочечная ДНК или же две цепи исходной молекулы разделяются в процессе репликации. В последнем случае (так называемая полуконсервативная репликация) вдоль каждой из двух разделившихся цепей должна синтезироваться новая комплементарная цепь, в результате чего образуются две новые двухцепочечные молекулы.
О получении первых экспериментальных данных, четко указывающих на полуконсервативный способ репликации, сообщили в 1958 г. Меселсон и Сталь [24]. Клетки Е. coli выращивались на среде, единственным Источником азота в которой были ионы 15NH4. ДНК бактерий, появившихся через несколько последовательных делений исходных клеток в Данной среде, содержала только стабильный изотоп 15N. Такие бактерии быстро переносили в среду, содержащую 14NH+4 Клетки оставляли в среди на время, необходимое, чтобы их количество увеличилось вдвое, вчетверо и т. д. На разных стадиях выделяли ДНК и центрифугировали в градиенте плотности хлористого цезия. Небольшие, но легко определяемые различия плотностей позволяли разделять двухцепочечные молекулы ДНК на три фракции: молекулы, содержащие только 15N; молекулы, содержащие только частично 15N, и молекулы, содержащие только 14N. В начале опыта присутствовал лишь один тип ДНК, все молекулы которой содержали только 15N. Однако в первом поколении, появившемся после переноса в среду с 14N, плотность всей ДНК указывала на то, что содержание 15N и 14N в молекулах ДНК было одинаковым. ДНК половины бактерий следующего поколения по-прежнему содержала в равных количествах оба типа изотопов, тогда как у другой половины в ДНК обнаруживали только I4N. Именно такие результаты можно было предсказать, исходя из полуконсервативного способа репликации.
Спустя несколько лет Кернс исследовал процесс репликации непосредственно, использовав метод радиоавтографии ДНК с применением тимидина, меченного радиоактивным изотопом водорода — тритием (3Н) [25]. Клетки E.coli выращивали на среде, содержащей 3Н-тимидин, в течение разных промежутков времени, но в типичном опыте — около 1 ч (примерно время двух генераций). Клетки затем разрушали, а расправленные молекулы ДНК выделяли на тонких мембранных фильтрах, после чего готовили радиоавтографы. В результате инкубации с 3Н-тимидином на радиоавтографе можно было обнаружить окружности длиной 1,1—1,4 мм, соответствующие выделенным расправленным молекулам ДНК. Более того, на радиоавтографах можно было заметить молекулы ДНК, меченные частично и находящиеся в процессе репликации. Так, после инкубации в течение 2 ч около половины молекул бактериальной ДНК были полностью мечены, тогда как у другой половины молекул наблюдали зоны, содержание метки в которых было в два раза меньше. Молекулы этих зон несли метку, по-видимому, лишь в одной цепи и, следовательно, соответствовали нереплицировавшимся участкам (один цикл репликации в присутствии 3Н-тимидина успели пройти все молекулы, и это привело к образованию слабо меченных молекул; однако второй цикл у части молекул репликации еще не завершился). Был сделан вывод, что наиболее интенсивно меченные зоны соответствуют молекулам, в которых репликация произошла полностью. Форма; «репликационных фигур» давала основание думать, что синтез ДНК происходит непрерывно, начинаясь в одной точке и продолжаясь далее вдоль кольцевой молекулы с постоянной скоростью. Несмотря на то что последующие опыты (разд. Д) показали, что репликация чаще всего происходит не в одном, а в двух направлениях, эксперименты Кернса имели чрезвычайно важное значение, так как легли в основу метода, позволяющего непосредственно наблюдать репликацию ДНК in vivo.
а. ДНК-полимеразы
Что же представляют собой предшественники ДНК? В ранних опытах было показано, что нуклеозид 3Н-тимидин интенсивно включается в ДНК. Однако с точки зрения энергетики представлялось маловероятным, что тимидин служит непосредственным предшественником. Данные о том, что роль предшественников играют нуклеозидтрифосфаты, были получены в 1958 г., когда Корнберг открыл ДНК-полимеразу E.coli. Для выделения 600 мг фермента Корнберга, называемого обычно ДНК-полимеразой I, понадобилось 90 кг бактериальных клеток [4, 26] (в каждой клетке содержится около 400 молекул фермента). Этот фермент обладал многими свойствами из предсказанных для ДНК-синтезирующего фермента. Для его работы требовались матричная цепь ДНК и более короткая затравочная цепь. Как это видно из уравнения (15-2), ДНК-полимераза I распознает 3'-конец затравочной цепи и присоединяет к нему соответствующий нуклеозидтрифосфат, образующий пару со следующим основанием матричной цепи. После этого он катализирует отщепление пирофосфата, присоединяя одновременно новый нуклеотид к 3'-концу затравочной цепи. «Работая» таким образом, фермент может превратить одноцепочечную ДНК-матрицу в двухцепочечную ДНК, причем в каждой точке новосинтезированной цепи этой ДНК будет содержаться основание, комплементарное основанию матричной цепи.
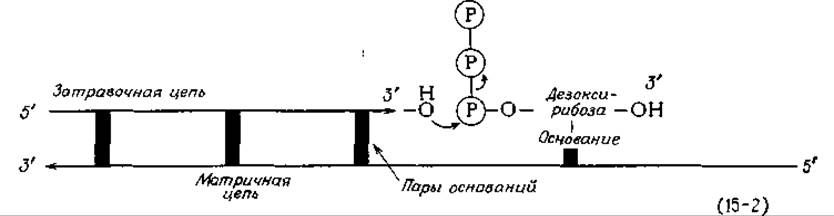
Механизм действия ДНК-полимеразы I, описываемый уравнением (15-2), обеспечивает лишь прямой путь образования комплементарной цепи ДНК; каким образом может осуществляться копирование двухцепочечной ДНК, с помощью этого механизма нельзя объяснить. Одна из проблем состоит в том, что для копирования двухцепочечной ДНК две цепи должны расплестись и отделиться одна от другой. Если расплетание цепей и репликация происходят лишь в одной репликационной вилке, как это следует из экспериментов Кернса, то для того, чтобы хромосома E.coli могла полностью реплицироваться за 20 мин, вся молекула должна раскручиваться со скоростью 300 оборотов в 1 с. Кроме того, для осуществления процесса репликации в хромосоме должно быть образование типа «шарнира» (или, по крайней мере, «разрыв» в одной из цепей) [уравнение (15-3)].
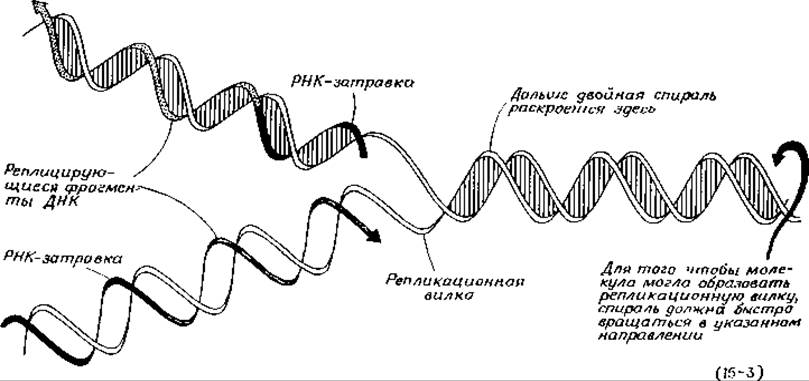
Более серьезная проблема связана с тем, что цепи ДНК ориентированы в противоположном направлении. Это означает, что присоединение новых нуклеотидов к одной из цепей в репликационой вилке должно происходить с 3'-конца, а к другой — с 5'-конца. Из этого следует, что для осуществления специфической полимеризации должно существовать два типа ДНК-полимераз, по одной для каждого из концов. Темне менее, несмотря на интенсивные поиски, все обнаруженные полимеразы (ДНК-полимеразы I, II и III) присоединяют новые остатки только к 3'-концам.
6. Репликационные фрагменты и ДНК-лигаза
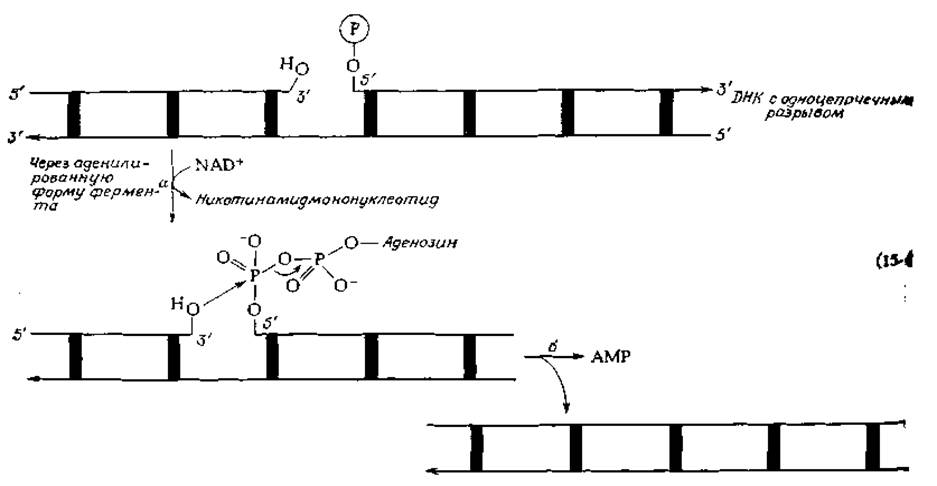
В 1968 г. Оказаки сообщил, что в процессе репликации в бактериальных клетках появляются короткие фрагменты ДНК, получившие название репликационных фрагментов (или фрагментов Оказаки) [27]. В дальнейшем было сделано еще одно важное открытие — был обнаружен новый фермент ДНК-лигаза [28, 29], способный объединять два фрагмента ДНК в непрерывную цепь. Специфическое действие этого фермента заключается в репарации («залечивании») одноцепочечных разрывов ДНК. Разорванная цепь молекулы ДНК содержит, как это видно из уравнения (15-4), свободные 3'-гидроксильную и 5'-фосфатную группы, которые должны быть соединены. ДНК-лигаза E.coli активирует фосфатную группу необычным способом, а именно путем замещения никотинамидмононуклеотида аденильной группой от NAD+ [уравнение (15-4), стадия а]. Реакция завершается отщеплением АМР [уравнение (15-4), стадия б]. Следует отметить, что в клетках, инфицированных бактериофагом Т4, индуцируется особая лигаза, для активации которой вместо NAD+ используется АТР.
в. Современное представление о репликации, требующей участия РНК-затравки
Недавно было обнаружено, что короткая цепь РНК, образующая гибрид РНК—ДНК, может служить затравкой для ДНК-полимеразы in vitro. Эти данные в сочетании с обнаружением фрагментов Оказаки и лигазы дают основание думать, что в репликационной вилке происходят следующие события: двухцепочечная ДНК раскрывается в ограниченном участке, вероятно, при участии расплетающих белков разд. Д). В специальной затравочной области синтезируется короткий фрагмент РНК-затравки, образующей пары оснований с ДНК. Далее ДНК-полимераза удлиняет эту цепь РНК, используя для синтеза репликационных фрагментов дезоксирибонуклеозидтрифосфаты. Синтез происходит вдоль обеих цепей в направлениях, указанных в уравнении (15-3). В дальнейшем затравочные РНК-концы отщепляются. Бреши в синтезированной цепи заполняются за счет дальнейшей работы полимеразы, а надрезы сшиваются под действием лигазы. Согласно этому механизму, одна цепь может синтезироваться непрерывно по всей длине, а другая должна образовываться дискретно, присоединением репликационных фрагментов. Однако у некоторых организмов обе цепи могут синтезироваться дискретно.
Поскольку большая часть новых данных по репликации получена генетическими методами, представляется целесообразным перенести дальнейшее рассмотрение этого вопроса в разд. Д.