Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Трансляция генетической информации. Синтез белка
Химический состав рибосом
Белоксинтезирующаяся система Е. coli включает 15 000 рибосом, которые составляют одну четвертую часть общей массы клетки. Выяснение устройства и механизма функционирования этих маленьких молекулярных машин, которые под электронным микроскопом имеют вид всего лишь неясных точек, является одним из основных направлений исследований современной молекулярной биологии [88].
Масса рибосом Е. coli составляет приблизительно 2,7∙106 дальтон; около 65% ее веса приходится на долю РНК, остальные 35% — на белок. В эукариотических клетках масса рибосом больше, чем в бактериальных, приблизительно в 1,6 раза (4,3∙106 дальтон). При определенных условиях, и в частности при низкой концентрации ионов Mg2+, цельные рибосомы (для бактерий это 705-рибосомы) диссоциируют на две субчастицы неодинакового размера — 30S- и 50S-рибосомные субчастицы. 50S-субчастица приблизительно в два раза больше 30S-субчастицы; в ее состав входят две молекулы РНК (23S и 5S) (табл. 15-4). Меньшая (30S) субчастица содержит одну молекулу 16S-PHK, полинуклеотидная цепь которой включает 1700 нуклеотидов; ее длина (если ее целиком распрямить) может превысить 500 нм. Нуклеотидная последовательность этой РНК полностью расшифрoвана.
Таблица 15-4 Масса рибосом Е. coil
|
Частица |
Рибосома, дальтоны (х108) |
РНК, дальтоны (х105) |
Белок (по разности) дальтоны (х103) |
|
50S-субчастица 30S-субчастица 70S-субчастица |
∼1,8 ∼0,9 ∼2,7 |
∼1,1 (23S) ∼0,04 (5S) ∼0,56 (16S) ∼1,7 |
∼0,7 ∼0,3 ∼1,0 |
Помимо сильно «упакованных» молекул РНК в состав 30S-субчастицы входит приблизительно 21 белковая молекула, различающаяся по аминокислотному составу и по аминокислотной последовательности (табл. 15-5). Многие из этих белков (их обозначают символами S1, S2, S3 и т. д.) имеют сравнительно небольшой мол. вес. Кроме того, многие из них обладают сильно выраженными основными свойствами. Они содержат большое число остатков лизина и аргинина, которые бесспорно обусловливают взаимодействие этих белков с молекулами РНК. Вместе с тем в состав 30S-субчастиц входит также несколько кислых и нейтральных белков. Рибосомная 50S-субчастица содержит — 34 различных белка, причем в одной субчастице может находиться несколько молекул белка одного и того же типа. Белковый состав рибосом может подвергаться изменениям, и установить его точно — задача довольно трудная. Большая часть белков (обычно их называют структурными единицами) присутствует в соотношении 1:1. Другие белки могут отсутствовать в некоторых рибосомах. Аналогично дополнительные копии некоторых субчастиц могут содержаться лишь в части рибосом. В процессе синтеза белка с функционирующими рибосомами временно может связываться ряд других белков.
Установление точных размеров и формы рибосом представляет собой трудную задачу. В настоящее время считают, что диаметр бактериальных рибосом составляет приблизительно 22 нм, а длина частицы, возможно, 30 нм. Рибосомы эукариотических клеток имеют приблизительно в 1,17 раз большие линейные размеры и содержат значительно большее число белков — около тридцати в малой субчастице и около сорока в большой [89]. Однако есть основание думать, что число белков, существенных для функционирования, в рибосомах эукариотических клеток такое же, как и в рибосомах Е. coli [90]. Интересно, что белки эукариотических рибосом (так же, как и молекулы рРНК) значительно крупнее, чем белки бактeриальных рибосом. Митохондриальные рибосомы в некоторых отношениях напоминают бактериальные, но имеют большие размеры и содержат приблизительно 66% белка (в рибосомах Е. coli содержание белка составляет лишь 35%).
Многочисленные данные свидетельствуют о том, что белки в рибосомах находятся в форме компактных молекул, у которых для добавляемых реагентов наиболее доступна поверхность. Молекулы РНК также в основном доступны для воздействий извне. Около 50% общей массы рибосом находится в гидратированном состоянии. Таким образом, рибосомы представляют собой структуры, в которые сравнительно легко может проникать растворитель. Большая часть РНК (возможно, 60— 70%) складывается, образуя петли со спаренными основаниями, как это имеет место в тРНК. Для выяснения физических основ, обусловливающих связывание различных рибосомных субчастиц друг с другом, было проведено большое число экспериментов. При этом было обнаружено, что белки S4 и S20 связываются непосредственно с 16S-PHK вблизи от ее 5'-конца, белки S8 и S15 — примерно в центре, а белок S7 — около 3'-конца; Было высказано предположение, согласно которому особо важную роль в организации рибосомы играет белок S4 [88]. Сейчас разработаны методы, позволяющие осуществлять полную диссоциацию рибосомных 30S- и 50S-субчастиц [91, 92] Е. coli на индивидуальные белки и РНК с последующей их реконструкцией в функционально активные рибосомы. В такого рода экспериментах было установлено, что важное значение для правильной реконструкции имеет последовательность добавления белков. Результаты этих опытов дают основания считать, что кроме белков S4, S7, S15 и S20 с S16-PHK связываются также белки S9, S13 и S17, а белок S16 связывается с белками S4 и S20 [93]. Остальные белки не нужны для восстановления структуры рибосомы, но необходимы для функционирования рибосомы. к ним относятся белки S3, S10, S12, S14 и S19. У большинства рибосомных белков ферментативной активности не обнаружено, однако вполне возможно, что они обладают какими-либо еще не установленными каталитическими свойствами.
Таблица 15-5 Рибосомные белки
|
Белки рибосомных 30S-субчастиц |
Белки рибосомных 50S-субчастиц |
||||
|
обозначение |
мол. вес |
связываниеa |
обозначение |
мол. вес |
связываниеа |
|
S1 |
65 000 |
L1 |
22000 |
||
|
S2 |
27 000 |
L2 |
28 000 |
+ |
|
|
S3 |
28 000 |
L3 |
23 000 |
||
|
S4 |
25 000 |
+ |
L4 |
28 500 |
|
|
S5 |
21 000 |
L5 |
17 500 |
||
|
S6 |
17 000 |
L6 |
21 000 |
+ |
|
|
S7 |
26 000 |
+ |
L7 |
15 500 |
|
|
S8 |
16 000 |
+ |
L8 |
19 000 |
|
|
S9 |
17 500 |
L9 |
|||
|
S10 |
17 000 |
L10 |
21 000 |
||
|
S11 |
L11 |
19 000 |
|||
|
S12 |
17 000 |
L12 |
15 500 |
||
|
S13 |
14 000 |
L13 |
20 000 |
||
|
S14 |
15 000 |
L14 |
18 500 |
||
|
S15 |
13 000 |
+ |
L15 |
17 000 |
|
|
S16 |
13 000 |
L16 |
22 000 |
+ |
|
|
S17 |
10 000 |
L17 |
15 000 |
+ |
|
|
S18 |
12 000 |
L18 |
17 000 |
+ |
|
|
S19 |
14 000 |
L19 |
17500 |
+ |
|
|
S20 |
13 000 |
+ |
L20 |
16 000 |
+ |
|
S21 |
13 000 |
L21 |
14 000 |
||
|
Сумма |
405 000 |
L22 |
17 000 |
||
|
L23 |
12 500 |
+ |
|||
|
L24 |
14500 |
+ |
|||
|
L25 |
12 500 |
+ |
|||
|
L26 |
12 500 |
||||
|
L27 |
12 000 |
||||
|
L28 |
15 000 |
||||
|
L29 |
12 000 |
||||
|
L30 |
10 000 |
||||
|
L31 |
|||||
|
L32 |
|||||
|
L33 |
9 000 |
||||
|
L34 |
|||||
|
Сумма 549 000 |
' |
||||
Знак + обозначает связывание непосредственно с рибосомной РНК.
Было показано, что белки L5, L18 и L25 50S-субчастицы специфически связываются с молекулой 5S-PHK, последовательность оснований в которой установлена (рис. 15-12). Известно также, что комплекс L5-L18-L25-5S-PHK связывается с олигонуклеотидом TpψpCpGp. Следовательно, можно предположить, что 5S-PHK взаимодействует с ТψС-плечом молекулы тРНК при ее связывании с рибосомой. Кроме того, было обнаружено, что L18+L5 (или L25) обеспечивают связывание 5S-PHK с 23S-PHK. В табл. 15-4 указаны остальные белки рибосомных 50S-субъединиц, связывающиеся с РНК.
Сейчас проводится много экспериментов с использованием реагентов, образующих поперечные связи между белковыми молекулами. В частности, используются бифункциональные соединения, способные ковалентно связываться с двумя различными —SH- или —NН2-группами [93—95]. Использование этого подхода дало возможность идентифицировать следующие связанные поперечными связями пары [93, 95]: S2-S3, S4-S6, S4-S8, S4-S9, S4-S12, S5-S8, S5-S9, S7-S8, S7-S9, S11-S18, S13-S19 и S18-S21. Другой подход состоит в том, чтобы получать специфические антитела к отдельным рибосомным белкам и изучать при помощи электронного микроскопа места их связывания на поверхности рибосомных субчастиц [96, 97]. Этим методом была установлена локализация многих белков на поверхности как 30S-, так и 50S-субчастиц (рис. 15-13). В ряде случаев антитела к определенному белку связывались сразу в нескольких участках. Тот факт, что связывающие места для антител к белкам S2, S12, S15 и S18 отстоят друг от друга на 8—19 нм, свидетельствует о том, что эти белки в 30S-субчастице находятся в вытянутой, фибриллярной конформации (рис. 2-12). На основании аналогичных данных считают, что белок S4 также имеет вытянутую форму, достигая в длину 17 нм [95], что обусловливает способность этого белка образовывать большое число поперечно связанных пар. Все это свидетельствует о том, что рибосома — это чрезвычайно сложная машина.
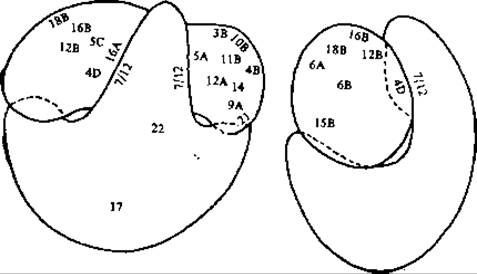
РИС. 15-13. Две проекции 70S-рибосомы Е. coli. Цифрами обозначены места связывания специфических антител к определенным рибосомным белкам (нумерация такая же, как в табл. 15-5). Буквы S и L не указаны, так как из рисунка и так ясно, в какой из субъединиц находится белок. В тех случаях, когда для какого-то одного антитела обнаруживается более чем одно место связывания, эти места обозначены буквами А, В, С и D. В других проекциях можно было бы увидеть много других идентифицированных мест связывания [97].