Биохимия - Химические реакции в живой клетке Том 3 - Д. Мецлер 1980
Биохимическая генетика и синтез нуклеиновых кислот и белков
Генетические методы
Картирование хромосомы бактериофага
Большая часть наших знаний в области биохимической генетики была получена в результате исследования бактериофагов. Интенсивное изучение «Т-четных» фагов Т2, Т4 и Тб было начато еще в 1938 г. Максом Дельбруком и его сотрудниками. Хотя размеры исследованных ими вирусов малы, тем не менее оказалось, что они относятся к числу наиболее сложно устроенных из известных вирусов (дополнение 4-Д). Генетической информации, содержащейся в одной линейной молекуле ДНК, которая в случае фага Т4 содержит 2∙105 пар оснований, достаточно для кодирования примерно 200 генов. Удалось установить положение 60 из этих генов на генетической карте. Ниже мы рассмотрим вкратце метод, при помощи которого это было сделано.
Инфицирование клетки Е. coli бактериофагом происходит следующим путем: фаг впрыскивает свою ДНК через клеточную стенку в цитоплазму. Приблизительно через 20 мин после этого клетка лопается, и из нее выходит около 100 полностью готовых копий исходной вирусной частицы. Такая высокая скорость размножения позволяет проводить в пробирке в течение 20 мин генетические эксперименты, для которых потребовалось бы все население земного шара, если бы эти опыты проводились на людях. Главные принципы, лежащие в основе этого метода, были ясно изложены Бензером [130], который впервые составил карту тонкого строения гена. Частицы бактериофагов, подобно бактериям, можно «посеять» в чашке с агаром. Отличие заключается лишь в том, что агар должен содержать однородную суспензию бактерий, чувствительных к вирусу. В какой бы участок чашки ни попали вирусные частицы, они заражают какую-либо бактерию. Вскоре инфекция распространяется на соседние бактерии и в результате образуется стерильное пятно (рис. 15-20). Число основных вирусных частиц, содержащихся в суспензии, можно легко определить, сосчитав число стерильных пятен, образовавшихся в результате посева.
Мутантные бактериофаги могут быть обнаружены различными способами, однако наиболее просто это можно сделать по внешнему виду образующихся пятен. Другой тип легко обнаруживаемых мутантов — это мутанты е нарушением специфичности к определенным штаммам бактерий-хозяев. Ключевым открытием, позволившим проводить генетическое картирование бактериофагов, явились данные о том, что внутри бактерии-хозяина может происходить генетическая рекомбинация между двумя частицами фага. Рекомбинация может быть проиллюстрировала следующим oбразом. Два разных мутантных штамма бактериофагов выращивают в больших количествах и смешивают их, добавив большой избыток бактерий. При этом в потомстве обнаруживается некоторое число вирусов, обладающих мутантными признаками обоих штаммов, и такое же число вирусов «дикого типа». Хотя рекомбинации между близко расположенными в ДНК мутациями происходят редко, их частота все же значительно превосходит частоту появления новых мутаций. Таким образом, описанный выше эксперимент, хотя и не позволяет говорить о природе событий, происходящих при рекомбинации, все же однозначно указывает на то, что рекомбинация происходит.
Изучение частот рекомбинаций между различными штаммами фагов вскоре показало, что некоторые сайты мутаций тесно сцеплены друг с другом. Рекомбинация между такими сайтами происходит редко. Другие же сайты сцеплены слабо друг с другом, и рекомбинации между ними происходят часто. Эта ситуация напоминает обнаруженную на много лет раньше ситуацию с генами плодовой мушки (дрозофилы)1), кукурузы и других высших организмов. Главная идея, на которой основано картирование хромосом любого организма, состоит в предположении, что частота рекомбинаций между двумя мутациями прямо пропорциональна расстоянию между местами этих мутаций на генетической карте. Для фага Т4 за единицу длины принята частота рекомбинаций, равная 1%. Вся карта Т4 состоит из 700 таких единиц. Тот факт, что это значение превышает 100%, означает, что если гены расположены на противоположных концах хромосомы, то рекомбинация между ними может происходить многократно. В действительности же между двумя отдаленными друг от друга генами удается наблюдать максимально 50% кроссинговера, а линейный характер зависимости частоты рекомбинации от расстояния на карте сохраняется лишь для расстояний, не превышающих 10 единиц [131].
Как можно быстро обнаружить рекомбинантный бактериофаг? Бензер использовал в качестве клеток-хозяев два штамма Е. coli: штамм В и штамм К. Бактериофаги с мутантным геном rII образовывали характерные пятна в чашках с бактериями штамма В, но не росли на бактериях штамма К. Для того чтобы определить частоту рекомбинаций между двумя разными rII-мутантами, вирусы добавляли к жидкой культуре В-клеток, в которых они реплицировались. В результате происходящей в этих условиях рекомбинаций появились не только фаги с обоими типами мутаций, но также и «стандартные» фаги, у которых в результате рекомбинации исчезали оба типа мутаций. Поскольку в клетках штамма К растут только рекомбинанты последнего типа, среди миллиардного потомства удается идентифицировать наличие даже единичного рекомбинанта. Предположим теперь, что суммарная длина ДНК фага Т4 составляет 200 000 пар оснований, т. е. на единицу длины карты приходится 286 пар. Частота рекомбинаций между двумя мутациями, равная 0,01%, означает, что в цепи ДНК эти мутации разделены всего лишь тремя парами оснований. Исходя из сказанного, Бензер пришел к выводу, что даже в тех случаях, когда мутации затрагивают основания ДНК, расположенные в непосредственной близости друг от друга, частота ожидаемой рекомбинации между этими двумя мутациями легко может быть определена.
1) Рекомбинацию хромосом у дрозофила путем кроссинговера впервые обнаружили в 1911 г. Морган и его сотрудники.
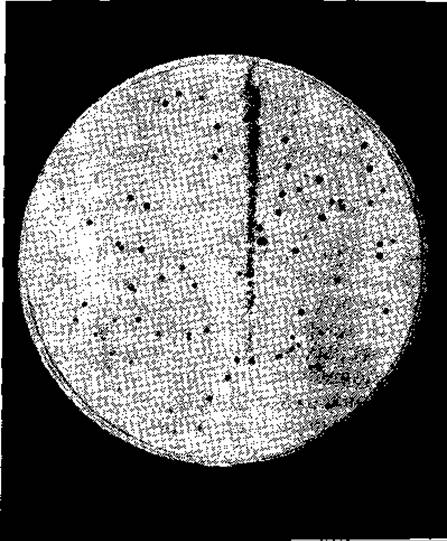
РИС. 15-20. Стерильные пятна, образованные бактериофагом — 11, растущим на Staphylococcus aureus. Каждое прозрачное темное пятно образовано в результате лизиса бактерий, вызванного потомством одной частицы (фото любезно предоставлено Pater Pattee).
Для того чтобы тонкое генетическое картирование можно было осуществить на практике, необходим еще один метод. Была составлена генетическая карта для ряда мутантных бактериофагов с делециями, захватывающими большие участки гена rІІ. С помощью этих мутантов можно было легко определить, в каком именно участке гена соответствующего мутанта находится данная мутация. Последующие эксперименты по рекомбинации с использованием предварительно идентифицированных мутаций позволяют уточнить локализацию мутации в ранее исследованном участке гена. Таким способом Бензеру удалось идентифицировать более 300 мутаций в гене rII. Он пришел к выводу, что минимальное расстояние между двумя мутантными участками полностью согласуется со строением гена, предложенным Уотсоном и Криком.