Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Пептиды в водных растворах
Тканеспецифические регуляторные пептиды
Атриопептиды
Натрийуретические пептиды были впервые описаны Де Болдом в начале 80-х годов (De Bold et al., 1981). Позднее выяснилось, что эти пептиды регулируют экскрецию солей из организма. Было показано, что атриопептиды (АП) выделяются из предсердий в условиях, когда миоциты стенки предсердия испытывают напряжение (растяжение). Регулируя диурез и сосудистый тонус, сердце способно освобождаться от избыточного объема циркулирующей жидкости и регулировать артериальное давление (Алексеенко, Орехович, 1987). Таким образом поддерживается кардиоваскулярный гомеостаз.
Гистологические исследования показали, что кардиоциты предсердий существенно отличаются от кардиоцитов желудочков тем, что содержат специфические гранулы, связанные с аппаратом Гольджи, что характерно для типичных эндокринных секреторных клеток. Это свидетельствует об уникальности кардиоцитов предсердий: они совмещают две физиологические функции — функцию мышечного сокращения и функцию эндокринной клетки. Выполняя эндокринную функцию, клетка обеспечивает себе выгодный режим мышечной работы (Gunning, Brenner, 1992).
АП происходят из общего предшественника; биологической активностью обладают пептиды с молекулярной массой от 3 до 44 кДа. Высокомолекулярные формы под действием протеолитических ферментов переходят в более активные низкомолекулярные формы. Наибольшей активностью обладают пептиды из 25—33 аминокислотных остатков.
Основное действие АП направлено на почки, где они снижают давление в капиллярах и увеличивают потоки ренальной плазмы. Действие АП начинается быстро, в течение 1—2 мин достигает максимума и завершается через 20— 30 мин.
Независимо от размера молекулы АП млекопитающих имеют общую характерную особенность: внутримолекулярная дисульфидная связь образует 17-членную кольцевую структуру. В табл. IV Приложения представлены аминокислотные последовательности АП, а на рис. 7 — первичные и вторичные структуры АП в двух разных конформациях: циклической и димерной. Димерная форма обладает пролонгированным действием по сравнению с циклическими формами. Для проявления биологической активности необходимо наличие свободных N- и С-концов, тогда как атриопептин-кольцо активностью не обладает. В то же время высокоактивный антипараллельный димер АП имеет не только упрочненную за счет цистиновых мостиков конформацию, но и по паре свободных N- и С-концов.
Кроме миокарда предсердий АП были обнаружены в гипоталамусе и нейронах мозга — натрийуретический пептид мозга и натрийуретический пептид типа С (две последние строки в табл. IV Приложения), а также в глазных камерах крыс (Stone, Glembotski, 1986). Более того, высокоспецифические рецепторы к АП обнаружены не только в клетках почечных канальцев, надпочечников, гладких мышц аорты и эндотелия сосудов, но и в клетках головного мозга. Несмотря на некоторую разницу в аминокислотном составе кольца, эти АП взаимодействуют также с антителами к кардионатрину (Gunning, Brenner, 1992).
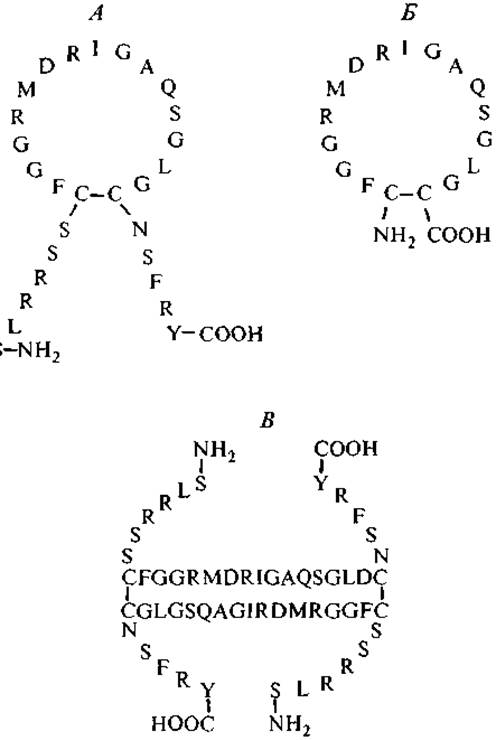
Рис. 7. Аминокислотные последовательности и конфигурации атриопептидов человека.
А — а-натрийуретический пептид; Б — атриопептин-кольцо; В — ß-натрийуретический пептид — антипараллельный димер.
Таким образом, в этой группе пептидов наблюдается та же закономерность, что и в других группах — пептиды, секретируемые клетками соматических тканей, обнаруживаются в соответствующих нейронах мозга, т. е. еще раз подтверждается наблюдение, что саморегуляция организма обеспечивается тканеспецифическими пептидами, но при этом контролируется центральной нервной системой.