Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Пептиды в водных растворах
Регуляторные пептиды как носители молекулярной информации
Роль водородных связей в передаче молекулярных сигналов
Выделение консервативных блоков аминокислот в, структурах пептидов и белков может быть использовано не только для оденки их информационной емкости, но и для постановки вопроса о молекулярных механизмах передачи и восприятия информационных сигналов. Сходство строения аминокислотных блоков в составе регуляторных пептидов и высокомолекулярных белков позволяет предположить, что передача информационных сигналов происходит по пути “от подобного к подобному” в соответствии с гипотезой П. К. Климова о том, что регуляторный пептид является молекулярным осциллятором, а передача его информационных сигналов : построена по принципу “камертон—резонатор” (Климов, Барашкова, 1993). Молекулярными резонаторами в общем смысле могут быть как участки полипептидных цепей высокомолекулярных белков, так и отдельные области бислойных липидных структур клеточных мембран. В ряде случаев, когда сигнал сохраняется в системе значительно дольше возможного времени жизни полипептида, возникает вопрос о физическом механизме дальнодействия и длительной трансляции сигнала в среде.
Расчеты предпочтительных конформаций пептидов выполняются, как правило, в предположении об изотропном окружении пептидной цепи. Только для достаточно длинных пептидных цепочек, т. е. для белковых макромолекул, учитываются внутримолекулярные гидрофобные взаимодействия жестких, обычно а-спиральных участков друг с другом при упаковке цепочки в глобулу. Это приводит к возникновению ядра молекулы, где сосредоточены гидрофобные аминокислотные остатки (Alberts et al., 1994). Внешние области белковых макромолекул, как правило, гидрофильны, так как боковые группы гидрофильных аминокислотных остатков экспонированы в сторону внешней водной среды и хорошо гидратированы; они участвуют в водородных связях с окружающим растворителем и в реакциях связывания лигандов (Норр, Woods, 1981). Методами ядерного магнитного резонанса (ЯМР) были измерены скорости изотопного обмена протонов, принадлежащих амино- и амидным группам высокомолекулярных полипептидов, на дейтерий и тритий воды (Knox, Rosenberg, 1980; Krauss, Cowbum, 1981). Эти измерения обнаружили большую разницу в скоростях обмена этих групп, находящихся во внутренних и внешних областях молекулы. Группы, находящиеся на внешней поверхности, пребывают в постоянном контакте с водой и обменивают свои протоны очень быстро — за доли секунды, тогда как группы, расположенные во внутренних областях белка (т. е. в областях с пониженной полярностью), обменивают протоны очень медленно — за минуты и часы.
По-видимому, эти малые скорости обмена определяются значительным временем релаксации внутримолекулярной подвижности полипептидов. Только изменение внешних параметров среды, например кислотности или температуры, влияет на скорость этих внутримолекулярных движений. Таким образом, большая разница между сравнительно медленной скоростью протонного обмена “пептид—вода” и практически мгновенной скоростью отображения этого обмена на системе водородных связей окружающей воды создает условия для непрерывного мониторинга конформации пептида.
Полифункциональные свойства пептидных цепей обеспечивают их чувствительность к механическим колебаниям и участие в электромагнитных колебаниях. Собственные колебания заряженных (протонированных или депротонированных) ионогенных групп полипептида вызывают обратимые смещения как низкомолекулярных противоионов, так и молекул воды, с ними связанных. Известно, что распространение механических колебаний в водной среде, содержащей заряженные частицы, приводит к локальному смещению положительных и отрицательных зарядов друг относительно друга и к возникновению ионного вибрационного потенциала (ИВП), который имеет ту же частоту, что и возбуждающее его колебание, например ультразвук. В случае заряженных макромолекул и коллоидных частиц в водной среде распространение ультразвука производит аналогичное действие: заряженная частица и окружающая ее “ионная атмосфера” осциллируют, индуцируя коллоидный вибрационный потенциал (КВП). Как правило, амплитуда КВП на несколько порядков больше амплитуды ИВП, и этот эффект используется в гидрофонах (Marlow et al., 1988).
Монохроматическая волна распространяется в среде и переносит энергию с определенной скоростью, но передать информационный сигнал с помощью монохроматической волны, очевидно, нельзя из-за ее однородности в пространстве и во времени. Для передачи информации нужно менять амплитуду или фазу волны. Математический аппарат решения этой задачи известен (Рабинович, Трубецков, 1984).
Среди многих возможных моделей молекулярного дальнодействия, пригодных для трансляции упорядоченных информационных сигналов, мы рассмотрим только системы сопряженных водородных связей, которые существуют как в пептидах, так и в окружающей их водной среде. На расстоянии 5—25 Å вокруг пептидной цепи с большой скоростью происходят конформационные перестройки водородных связей гидратной воды, отражающие состояние пептида. Эти изменения можно наблюдать по спектрам ЯМР, как это представлено на рис. 8, А. В разделе 1.2.3 мы уже упоминали о фундаментальной взаимосвязи между конформационными переходами пептидной цепи и изменением характера ее локальной гидратации. На рис. 8, Б представлено возрастное уменьшение прочности клатратных структур в колагене, что соответствует дегидратации соединительной ткани у различных животных.
Для изучения структуры гидратной воды и подвижности ее протонов существуют три диапазона электромагнитных колебаний: рентгеновский, инфракрасный и радиодиапазон. В молекулах воды наиболее низкими частотами (4 ∙ 104 Гц) характеризуются колебания ядерных спинов, соответствующие переходам между основным состоянием молекулы, когда спины протонов антипараллельны, и возбужденным состоянием, когда они параллельны. Эти частоты малы по сравнению с частотами обмена протонами между молекулами воды (1013—1014 Гц) и относятся к радиодиапазону. Интересно, что по порядку величины они сравнимы с механическими колебаниями (102—104 Гц), т. е. звуковыми волнами музыкального диапазона (Габуда, Ржавин, 1978). На рис. 8 представлен диапазон электромагнитных колебаний, используемых для изучения структуры гидратной воды.
По-видимому, низкочастотный (в радиодиапазоне) ЯМР-спектр связанной воды может дать уникальную информацию о взаимодействиях регуляторных пептидов с системой водородных связей воды.
При рассмотрении молекулярных осцилляторов мы должны учитывать особенности их строения и соответствующие диапазоны частот колебаний, в которых они могут принимать участие.
Первая характерная черта олигопептидов, подробно обсуждавшаяся в разделе 1.2.1, — это их пространственная асимметрия, которая включает структурную (компонентную) неоднородность, хиральность, неоднородное распределение электростатических зарядов и соответствующий усредненный вектор собственного дипольного момента.
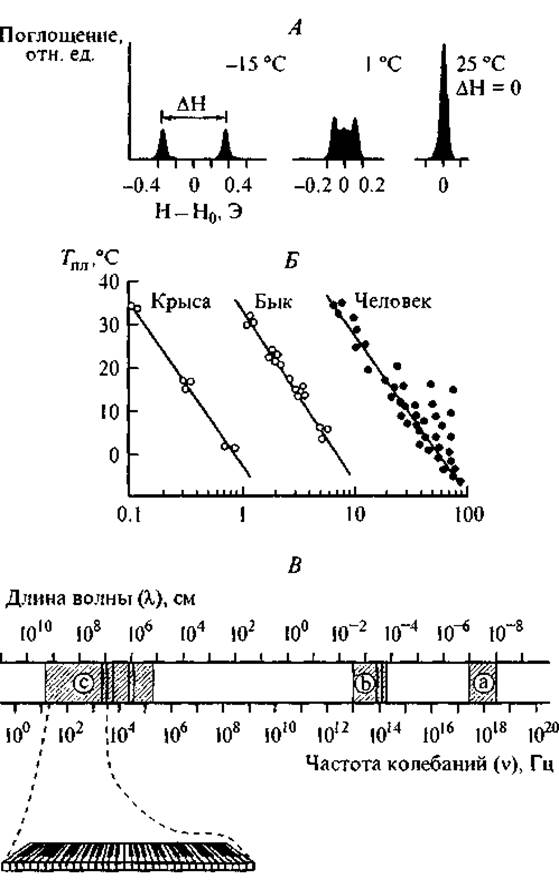
Рис. 8. Исследование клатратных структур в коллагене с помощью ЯМР-спектроскопии (Габуда, 1982; рисунок приводится с разрешения автора).
А — изменение ЯМР-спектра протонов воды при разрушении клатратных структур в результате повышения температуры в гидратированном коллагене; Б — зависимость между температурой плавления гидратов коллагена и возрастом (число лет) человека и животных; В — шкала электромагнитных колебаний и три основных диапазона для изучения структур гидратов: а — рентгеновский, b — инфракрасный, с — радиодиапазон. Некоторые частоты колебаний протонных спинов в связанной воде относятся к звуковому диапазону.
Вторая особенность олигопептидов — неоднородное распределение вдоль цепи гидрофильных и гидрофобных боковых групп, в результате чего возникает неоднородность гидратации, включающая разный тип гидратации карбоксильных и аминогрупп. Это приводит к характерному для данного олигопептида чередованию гидратных и клатратных структур связанной воды (Габуда, 1982).
Третья особенность олигопептидов — неоднородное распределение групп, способных вступать в водородные связи как с растворителем, так и с соседними группами. При определенных условиях водородная связь может сопровождаться переносом протона к протон-акцепторному атому и образованием ионной пары.
Внутримолекулярные ион-ионные связи в пептидах — большая редкость, а в коротких олигопептидах они не осуществляются по стерическим причинам. В большинстве случаев полярные межмолекулярные взаимодействия пептидов основаны на притяжении карбоксильных и аминогрупп. Такое взаимодействие не является чисто ион-ионным, так как взаимодействующая пара находится в двух энергетических состояниях:
АН…В ⇄ А- — НВ+.
Подобная молекулярно-ионная таутомерия имеет квантовый характер и потому химически не лимитируется.
Механизм и закономерности возникновения водородных связей с переносом протона детально изучены на примере низкомолекулярных протон-донорных и протон-акцепторных соединений. В этих исследованиях широко использованы методы инфракрасной (ИК) спектроскопии. Колебательные спектры партнеров (например, кислотной группы А и основной группы В) при образовании комплекса АН....В изменяются сильнее и специфичнее всех других физико-химических свойств системы (Иогансен, 1981). Изменения ИК-спектра отражают 1) появление нескольких новых колебаний новой частицы АН....В вместо исчезающих трансляций и вращений молекул АН и В; 2) радикальные изменения характеристических колебаний атома водорода в группе АН (vAH); 3) сдвиги частот некоторых скелетных колебаний молекул, содержащих группы АН и В.
Дипольный момент водородной связи обычно не превышает 2—3 Д, тогда как дипольный момент ионной пары достигает величины 15 Д, т. е. в 4 раза больше дипольного момента пептидной связи и в 8 раз больше дипольного момента воды. Поэтому локальная ориентация молекул воды в гидратационной оболочке взаимодействующих групп будет перестраиваться в зависимости от смещения равновесия в одну или другую сторону. Скорость таких перестроек соответствует частоте обмена протонами между молекулами воды и имеет диапазон величин 1012—1013 с-1, т. е. значительно выше скорости смещения таутомерных равновесий.
Кроме ЯМР- и ИК-спектроскопии при исследовании водородных связей с переносом протона в биополимерах широко используется метод рентгеноструктурного анализа. Теоретические расчеты на основании полученных данных показали возможность формирования триплетных структур связанной воды фрактального типа, т. е. структур, сохраняющих группу симметрии в больших масштабах, чем молекулярные (Бульенков, 1990). Эффективная подвижность протонов в подобных структурах должна быть еще выше, так как она не лимитируется частотой обмена протонами между отдельными молекулами, а определяется физическими свойствами протона.
Особенность протона, отличающая его от всех заряженных ионов в воде, состоит в том, что он не имеет электронов вокруг ядра, так что его радиус равен 10-13 см, т. е. на пять порядков меньше, чем радиус обычных ионов. Поэтому перенос протона от молекулы к молекуле происходит без перестройки электронных структур и без участия сил отталкивания между электронами (Белл, 1977). В определенном смысле физические свойства протонов в воде совпадают с физическими свойствами элементарных частиц.
Вычисления показывают, что длина волны протонов, движущихся при нормальной температуре с тепловой скоростью, определяемая по уравнению де Бройля
![]()
равна 10-8—10-9 см. Можно предполагать, что при перестройке локальной водородной связи трансляция этого процесса в воде может происходить по механизму туннелирования протона, т. е в результате “подпорогового” преодоления энергетических барьеров (Белл, 1977; Гольданский, 1979). На том же основании можно предполагать определяющую роль протонов клатратной воды в пространственном распространении сигналов об установлении водородных связей регуляторных пептидов с рецепторными белками.
Митчелл придавал особое значение протонам и динамике кооперативных водородных связей в биологических системах, используя понятие “протонно-движущей силы” по аналогии с электродвижущей силой (ЭДС). В середине 50-х годов, когда интенсивно начали развиваться работы по изучению структуры и функций митохондриальных мембран, квантовая электроника развивалась в области закрытых технологий, а понятие “полупроводник” еще не вошло в биофизику. Митчелл фактически ввел аналогичное понятие в биофизику мембран: он постулировал анизотропию проводимости для протонов в митохондриальных мембранах (см.: Mitchell, 1976).
В следующей главе мы подробнее рассмотрим строение биологических мембран. Их структурные особенности обеспечивают не только участие мембран и их рецепторов в межмолекулярных взаимодействиях с пептидами, но и функцию упорядоченной диэлектрической среды, специально предназначенной для распространения и усиления электромагнитных колебаний определенной частоты.
Транспорт энергии с помощью протонов очень прост, так как требует только тонкой, топологически замкнутой мембраны, непроницаемой для воды, которая расположена между двумя протон-проводящими средами, различающимися концентрацией свободных протонов. Иначе говоря, между двумя средами, разделенными мембраной, должна поддерживаться разница значений pH. Эти условия необходимы не только для функционирования протонного насоса, но и для трансляции информационных сигналов из внешней среды во внутриклеточное пространство и для сопряжения окислительно-восстановительных реакций с системами подвижных водородных связей в каждой среде.
Митчелл предложил ввести в биофизику понятие “proticity” по аналогии с “electricity”, указывая на определяющую роль “протонных насосов” в энергетике живой клетки (Mitchell, 1976). Используя русские суффиксы, мы можем перевести этот термин как “протоника” (по аналогии с “электроникой”) и использовать данное понятие не столько для процессов переноса энергии, сколько для процессов трансляции молекулярной информации между живыми клетками и организмами в водной среде.