Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Пептиды в водных растворах
Физико-химические особенности пептидов
Гидрофильно-гидрофобные свойства олигопептидов
Как уже указывалось, диссоциация цвиттерионов, в частности пептидов, протекает как сложный многоступенчатый процесс, который характеризуется несколькими константами ионизации. Изменение заряда одной ионогенной группы не только влияет на ее взаимодействие с неорганическими противоионами (Na+, К+, Са2+), на поляризуемость и суммарный дипольный момент пептида, но и изменяет, как указывалось выше, ориентацию молекул окружающей воды и смещает баланс между гидратной и клатратной гидратацией всей молекулы. Таким образом, диапазон биологической активности дипептидов расширяется за счет более высокой чувствительности к изменению ионной силы и кислотности окружающей среды: их активность в организме проявляется при меньших молярных концентрациях, но с большей селективностью по сравнению с отдельными аминокислотами.
Для примера можно рассмотреть строение и регуляторные свойства трех дипептидов: карнозина, тимогена и вилона, которые подробно описаны в литературе (Хавинсон, Жуков, 1992; Кузник и др., 1998; Hipkiss et al., 1998; Морозов и др., 20006).
Карнозин
Дипептид карнозин (ß-аланил-гистидин) впервые был выделен из мышечной ткани, а затем обнаружен во всех иннервированных тканях в концентрации до 20 мМ. На рис. 3 представлена его молекулярная структура, особенность которой состоит в сочетании имидазольного кольца гистидина на С-конце молекулы с ß-аминогруппой — на другом конце. Эта аминогруппа в ß-положении расположена достаточно далеко от плоскости пептидной связи и поэтому сохраняет более высокую подвижность при свободе вращения вокруг С—С- и N—С-связей, чем аминогруппа в а-положении. Нужно отметить особые свойства имидазольного кольца гистидина. Для свободного гистидина константа диссоциации этой боковой группы рКа = 6.0, т. е. эта группа слабее, чем вода (рКа = 7.0), ассоциирует протон (Чанг, 1980). Однако два атома азота (Nп и Nт) различаются по удаленности от основной пептидной цепи и по электрон-донорным свойствам. В результате изменение степени диссоциации одного из них сопровождается перемещением электронной плотности по кольцу и обеспечивает участие гистидина в лигандных и окислительно-восстановительных взаимодействиях, когда его а-аминогруппа включается в пептидную связь. Возможно, поэтому карнозин благоприятно влияет на гликолиз и окислительное фосфорилирование, увеличивая количество образующегося АТФ. Кроме того, карнозин увеличивает эффективность активного транспорта К+ и Na+ через цитоплазматическую мембрану.
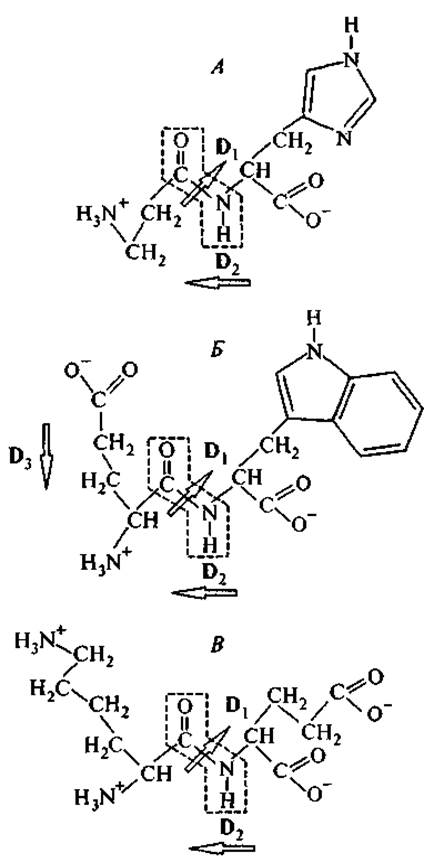
Рис. 3. Структурные формулы карнозина (А), тимогена (Б) и вилона (В).
В рамке — плоскость пептидной связи, которая находится в плоскости страницы. Стрелками обозначены дипольные момента D пептидной связи и боковых групп. Вектор локального дипольного момента направлен от отрицательного заряда к положительному.
В печени, надпочечниках, селезенке и в секрете слизистой тонкого кишечника находится фермент карнозиназа, расщепляющий карнозин на ß-аланин и гистидин. Известно, что карнозин препятствует переписному окислению липидов, активирует восстановление поврежденных тканей, эффективен при лечении старческой катаракты. В настоящее время для этой цели препарат карнозина выпускается в виде глазных капель.
Сравнительно недавно было показано, что карнозин также защищает мозговую ткань от образования амилоидозных отложений белка. Амилоидоз — системное заболевание, характеризующееся отложением белково-углеводных комплексов в межклеточном пространстве нервной ткани. Кроме ассоциации пептидных фрагментов в этом процессе важную роль играет сшивка пептидных фибрилл альдегидными группами редуцирующих сахаров и малоновым диальдегидом, который является вредным конечным продуктом окисления липидов. Защитный эффект карнозина при амилоидных перерождениях ткани обеспечивается, по-видимому, электрон-акцепторной активностью имидазольного кольца, препятствующей переписному окислению. Однако эта активность проявляется только после включения гистидина в состав дипептида, имеющего значительный дипольный момент и пространственную стабилизацию кольца относительно этого диполя. Свободный гистидин такой активностью не обладает (Alberts et al., 1994). Определенную роль в дестабилизации амилоидных отложений, возможно, играет и ß-структура аланина (Iverson, 1997).
Тимоген
Дипептид тимоген (L-глутамил-L-триптофан) был впервые выделен из олигопептидных фракций препаратов тимуса. После того как была обнаружена его активность в отношении стимуляции Т-лимфоцитов, этот дипептид был получен химическим синтезом и в настоящее время широко применяется в медицине (Морозов, Хавинсон, 1996; Кузник и др., 1998; Морозов и др., 2000б). Его структура представлена на рис. 3.
Карнозин и тимоген сочетают в структуре гидрофильную и гидрофобную части, которые в водном растворе располагаются с разных сторон от плоскости пептидной связи. Гидрофильные группы этих дипептидов (левые части молекул, изображенных на рис. 3) различаются знаком заряда: у карнозина это положительно заряженная аминогруппа, у тимогена — отрицательно заряженная карбоксильная группа. Если остаток глутаминовой кислоты тимогена не находится в пироформе, то его молекула имеет два локальных противоположно ориентированных дипольных момента: между С- и N-концами дипептида (D2) и между а-амино- и карбоксильной группами остатка глутаминовой кислоты (D3). Таким образом, суммарный постоянный дипольный момент у тимогена оказывается меньше, чем у молекулы карнозина.
Отличительная особенность молекулы тимогена состоит в том, что она сочетает самый гидрофильный (глутамил) и самый гидрофобный (триптофан) аминокислотные остатки. Наличие триптофана отличает тимоген от всех известных пептидных регуляторов тимической системы и сближает его с нейропептидами класса нейромединов и пептидовлиберинов. В то же время тимоген обладает всеми иммуномодулирующими свойствами тималина, но значительно превосходит последний по удельной активности (Хавинсон, Жуков, 1992). Исследования показали, что тимоген in vitro способствует регенерации специфических рецепторов Т- и В-лимфоцитов и активации мононуклеарно-фагоцитарной системы (Морозов, Хавинсон, 1997; Киселева и др., 1999), a in vivo у больных с вторичным иммунодефицитом он нормализует содержание Т-хелперов, Т-супрессоров и В-лимфоцитов (Кузник и др., 1999; Морозов и др., 2000б).
По-видимому, сочетание большой гидрофобной боковой группы триптофана и компенсированной диполярности облегчает взаимодействие тимогена с гидрофобными участками клеточных мембран. В частности, было показано, что после пришивки дипептида EW к N-концу а-спирального полипептида (LSSLLSL)3 удлиненный полипептид связывается с поверхностью клеточной мембраны, проникает в ее бислойную фосфолипидную структуру, образует в мембране ионные каналы и тем самым изменяет селективность ионного транспорта (Lear et al., 1997). Это один из нескольких примеров того, что триптофановый остаток вблизи N-кониа полипептидной цепи повышает селективность взаимодействия полипептида с внешней поверхностью клеточной мембраны.
Вилон
Дипептид вилон (L-Lys—L-Glu) был сконструирован на основании статистического анализа аминокислотного состава препарата Тималин (Морозов и др., 2000б; Хавинсон, 20016). Данные табл. III Приложения свидетельствует о том, что этот дипептид представляет собой структурный элемент многих тимических гормонов. Как показывает рис. 3, отличительной особенностью этого дипептида является отчетливое разделение электростатических зарядов между двумя его концами: положительно заряженные аминогруппы принадлежат остатку лизина, а отрицательные заряды сосредоточены на остатке глутаминовой кислоты. Такая структура свидетельствует о способности вилона активно участвовать в электростатических (ион-ионных и ион-дипольных) взаимодействиях.
Изучение влияния тимогена и вилона на развитие органотипических культур тимуса и селезенки обнаружило их одинаковое стимулирующее действие на эксплантаты тимуса, но различное — на эксплантаты селезенки, полученные от животных разного возраста: тимоген стимулировал рост ткани как старых, так и молодых животных, а вилон — только старых (Хавинсон и др., 1999; Чалисова и др., 1999). Дальнейшие исследования показали, что вилон обладает выраженным стабилизирующим и регенерирующим воздействием на морфофункциональные характеристики органотипической культуры селезенки и оказывает стимулирующее влияние на стромальное микроокружение клеток в старых и переживающих культурах. В различных моделях преждевременного старения, вызванного гамма-облучением, обнаружено, что вилон модулирует иммунный гомеостаз животных, стимулирует репаративные процессы в вилочковой железе, повышает пролиферативную активность тимоцитов, таким образом ускоряя компенсацию микроциркуляторных расстройств в тимусе и селезенке (Хавинсон и др., 2001д; Князькин, Полякова, 2002; Князькин и др., 2002). Другими авторами было установлено, что вилон является наиболее
коротким регуляторным фрагментом, который способствует доставке трансфакторов в ядро или входит в структуру функционально активных центров трансфакторных комплексов, необходимых для активации транскрипции гена интерлейкина-2 в лимфоцитах (Хавинсон и др., 2000в). Дальнейшие исследования показали, что вилон способен усиливать активность нейтральной сфингомиелиназы, либо модулируя прохождение по сфингомиелиновому пути известных сигналов биологически активных веществ, в частности ИЛ-1ß, либо прямо передавая свою информацию в тимоциты через этот путь сигнальной трансдукции (Хавинсон и др., 2002б).
Исследование биологической активности вилона, проведенное на мышах линии СВА, обнаружило существенное увеличение максимальной продолжительности жизни этих животных в результате введения им препарата. При этом применение вилона оказывало угнетающее действие на развитие злокачественных опухолей и новообразований у самок мышей СВА (Хавинсон, Анисимов, 2000; Анисимов В. Н. и др., 2002а). Изучение влияния вилона на экспрессию генов показало, что гены, уровень экспрессии которых изменялся под действием пептида, относятся к самым разным клеточным системам. Однако наиболее широко среди них представлены гены клеточного деления и защитных систем клетки и организма. В частности, значимым можно считать изменение экспрессии генов, имеющих отношение к регуляции клеточного цикла и мембранного транспорта, а также генов, имеющих отношение к онкогенезу и обмену кальция (Анисимов С. В. и др., 2002).
Таким образом, регуляторное и иммуномодулирующее действие вилона на механизмы регенерации и канцерогенеза опосредовано стромальными клетками микроокружения (макрофаги, фибробласты, тучные клетки, эндотелиальные и ретикулярные клетки) и реализуется через микроциркуляторное русло. Данные, полученные при экспериментальных исследованиях биологического действия вилона, позволяют рекомендовать его дальнейшее изучение в качестве геропротекторного препарата. Применение вилона в гериатрии является целесообразным для коррекции возрастных нарушений ангио- и иммуногенеза, а также модулирования клеточной пролиферации и ингибирования канцерогенеза.
Значения суммарной гидрофобности боковых групп карнозина, вилона и тимогена, рассчитанные по данным табл. 1 (1.5, 5.1 и 15.2 кДж/моль соответственно), показывают, что наименьшей гидрофобностью, т. е. наибольшей гидрофильностью, обладает молекула карнозина. По-видимому, его гидрофильность играет определенную роль в дестабилизации гидрофобных амилоидных ß-структур (см. раздел 1.2.3)
Чередования аминокислотных остатков с положительно и отрицательно заряженными боковыми группами характерны для большинства гидрофильных дипептидов, проявляющих биологическую активность. Например, Lys—Asp и Glu—Arg рассматриваются как простейшие регуляторы и стимуляторы физиологических функций (Белокрылов и др., 1998). При этом спектр функций, которые оказываются под влиянием рассматриваемых пептидов, очень широк и не обнаруживает тканеспецифичности. Можно предполагать, что эти молекулы не только сами проявляют регуляторную активность, но и могут быть агонистами других эндогенных регуляторов (в том числе непептидных), повышая чувствительность клеточных рецепторов к их действию.
Рассмотренные выше биологически активные дипептиды имеют сравнительно простую структуру и при этом способны участвовать в межмолекулярных взаимодействиях разного типа. Удлинение пептидной цепи повышает полифункциональность молекулы и увеличивает спектр ее регуляторных функций. В качестве примера можно привести синтетический тетрапептид Эпиталон (Анисимов и др., 2001).