Фармакогнозія з основами біохімії рослин - Ковальов В. М. 2004
Спеціальна частина
Ефірні олії
Тритерпени та тритерпенові сапоніни
Тритерпени мають у молекулі ізопренову одиницю C5H8, яка повторюється шість разів і утворює сполуки сумарної формули С30Н48. Будова тритерпенів звичайно циклічна, за винятком сквалену, який є біогенетичним попередником тритерпенів і стероїдів.
Тритерпеноїди містяться у рослинах у вільному стані та у вигляді глікозидів, які називають тритерпеновими сапонінами.
Біосинтез
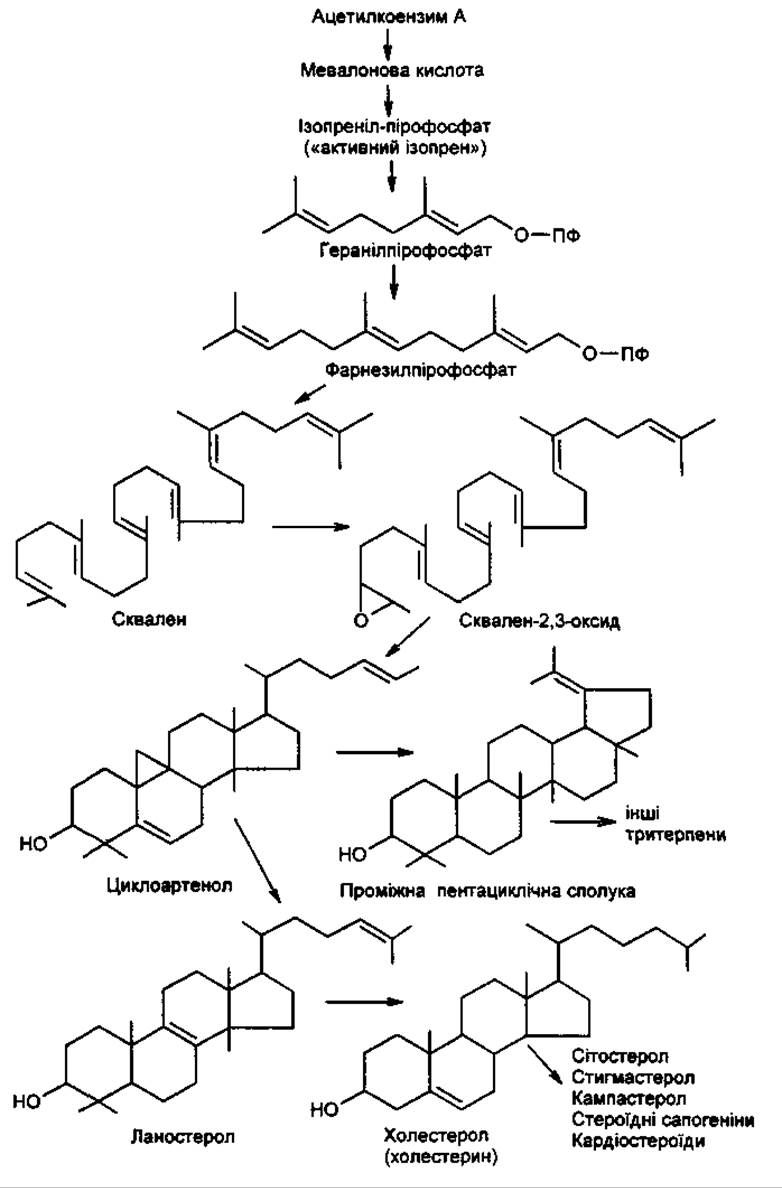
Остання біохімічна концепція біосинтезу свідчить, що тритерпеновий С30-попередник синтезується з’єднанням двох фарнезильних С15-залишків «хвіст до хвоста», з якого після проходження декількох проміжних стадій утворюється сквален.
Сквален перетворюється на сквален-2,3-оксид, у молекулі якого атом С-3 асиметричний. Далі він циклізується. Цією реакцією фотосинтезуючі рослини, які утворюють циклоартенол, відрізняються від нефотосинтезуючих організмів (гриби, тварини), у яких продуктом метаболізму є ланостерол. Шлях від сквален-2,3-оксиду до пентациклічних тритерпенів, наприклад а-амірину, підкріплений значними експериментальними даними.
Будова і класифікація
За кількістю циклів у молекулі тритерпеноїди поділяють на тетрациклічні та пентациклічні. Останні більш поширені. Відомо понад 3000 тритерпенових сполук, що відносяться за будовою до 20 основних типів.
Загальний шлях біосинтезу тритерпенів та стероїдів
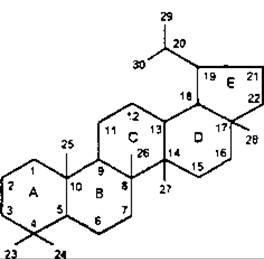
Головні типи тетрациклічних тритерпенів являють собою похідні родоначальних вуглеводородів: ланостану, циклоартану і дамарану.
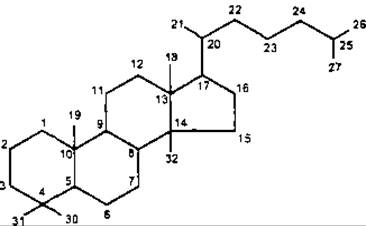
Ланостан
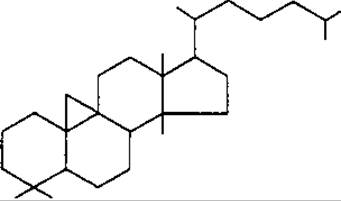
Циклоартан
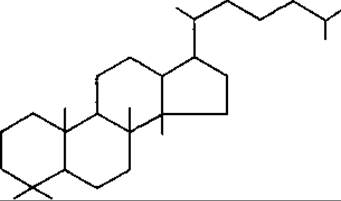
Дамаран
У формулі ланостану наведено нумерацію вуглецевого ядра, де атоми С-28 і С-29 зарезервовані для додаткових атомів вуглецю, які у рослинних стеролах приєднані до С-24.
До підгрупи дамарану відносять аглікони сапонінів женьшеня Panax ginseng, Araliaceae. Похідні циклоартану знайдені в родинах Fabaceae, Ranunculaсeae та ін.
Найпоширеніші типи пентациклічних сапонінів — це типи лупану, гопану, фріделану, урсану (а-амірину), олеанану (ß-амірину).
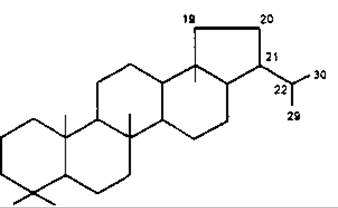
Лупан
Гопан
Фріделан
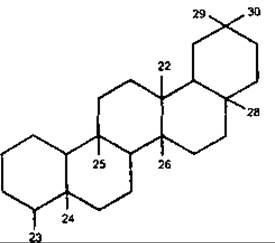
Урсан
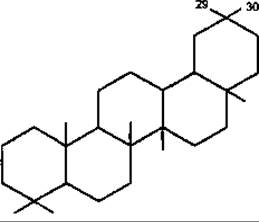
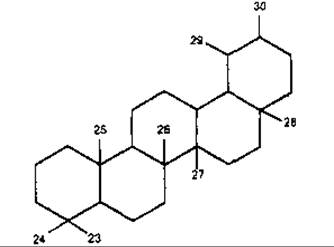
Олеанан
З функціональних груп у положеннях С-2, С-3, С-4, С-14, С-16, С-17, С-19 можуть бути гідроксильні, метильні, метоксильні, альдегідні, кетогрупи, лактонні й ефірні радикали. Тритерпеноїди, що містять альдегідну, лактонну групи або ефірні зв’язки, нестійкі та можуть змінюватися у процесі виділення з рослин. Значна частина пентациклічних сполук містить у своєму складі кислотне угрупування. Звичайно сахарними залишками заміщується гідроксил у С-3, карбоксильна група або обидві групи разом, утворюючи дисахариди. Подвійний зв’язок найчастіше зустрічається у положеннях С12-С13 або С20-С21.
Поширення
Тритерпеноїди визначені більш як у 70 родинах, для яких вони часто бувають хемотаксономічними маркерами. У природі найчастіше зустрічаються похідні а- і ß-амірину, наприклад олеанолова, урсолова та бетулінова кислоти, але більший фізіологічний вплив мають сапоніни. Тритерпеноїди локалізуються у живиці, молочному соку, покривних тканинах багатьох рослин, наприклад у родині Rosaceae (Potentilla erecta, Rubus caesius та ін.), а також у грибах (lnonotus, Ganoderma). Біологічна роль тритерпеноїдів у життєдіяльності рослин остаточно не з’ясована.
Фізико-хімічні властивості
Тритерпеноїди у вільному стані, як правило, кристалічні сполуки з чіткою температурою топлення, нелеткі. Це ліпофільні речовини, які розчинні в органічних розчинниках і нерозчинні у воді. Навпаки, їх глікозиди (сапоніни) розчинні у спирто-водних розчинах і воді. Тритерпеноїди, у складі яких є карбоксильна група, розчинні у спирто-водних розчинах малої концентрації. Розчини мають нейтральну або кислу pH. Кислотність обумовлюють карбоксильні групи. Кислі тритерпеноїди утворюють солі з одновалентними металами (розчинні у воді) і з дво- або багатовалентними металами (нерозчинні у воді).
Тритерпеноїди мають багато спільних властивостей із стероїдами, дають позитивну реакцію Лібермана-Бурхарда. Відрізнити їх від стероїдів можна за реакцією Розенгейма з трихлороцтовою кислотою або реакцією Брієскорна та Брінера з хлорсульфоновою кислотою. Спиртові гідроксили в молекулі ацетилюються; похідні ідентифікують спектральними методами (ІЧ, ЯМР, ПМР).
Молекули тритерпеноїдів мають багато центрів асиметрії та подвійний зв’язок у циклічних структурах, що є передумовою для геометричної та оптичної ізомерії. Часто ЛРС містить суміш конформаційних ізомерів.
Серед тритерпеноїдів медичне застосування мають тритерпенові глікозиди, але для деяких вільних тритерпеноїдів встановлена фармакологічна активність: протизапальна, протипухлинна, гіпоглікемічна. Звичайно тритерпеноїди супроводжують основні біологічно активні речовини і роблять свій внесок у прояв сукупного терапевтичного ефекту, наприклад у квітках нагідок, сировині глоду, коренях кульбаби і цикорію тощо.
Найважливіші тритерпеноїди
Лупеол — пентациклічний тритерпеноїд типу лупану, вперше виділений з жовтого люпину Lupinus luteus, Fabaceae. Сам або з а- та ß-амірином локалізується у молочному соку або корі, наприклад вільхи Ainus glutinosa, Betulaceae, пагонах омели Viscum album, Loranthaceae та ін.
Бетулін був першою тритерпеновою субстанцією, яка виділена з рослин (Lowitz, 1878). У значній кількості міститься у корі берези (до 2,5 %) та інших дерев. Має антисептичні властивості. Бетулінова кислота також міститься у корі різних дерев та травах, наприклад аврані лікарському Graciola officinalis, Scrophulariaceae. Трава аврану інтенсивно вивчається як сировина, що має противірусну активність.
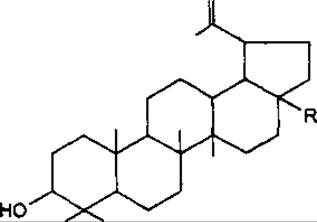
Тритерпеноїди групи лупану
R = H — Лупеол
R = СН2ОН — Бетулін
R = СOOН — Бетулінова кислота
Фріделін — пентациклічний тритерпеноїд типу фріделану; міститься у коркових покривних тканинах рослин, а також у роді Crataegus, Rosaceae. Має протизапальні властивості.
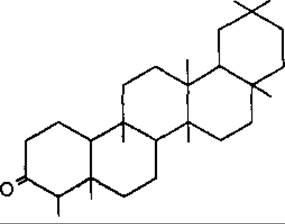
Фріделін
а-Амірин належить до групи урсану, має цис-конфігурацію циклів D/E, часто міститься у живиці. Урсолова кислота вперше була виділена з листків мучниці Arctostaphylos uva ursi, Ericaceae, звідки отримала назву. Міститься в інших представників Ericaceae, а також в омелі, шавлії, глоді, барвінку малому та ін. Має цитостатичні та протизапальні властивості, знижує рівень холестерину в крові.
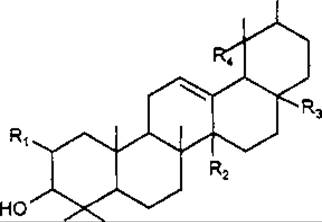
Тритерпеноїди групи урсану |
R1 |
R2 |
R3 |
R4 |
а-Амірин |
H |
CH3 |
CH3 |
H |
Урсолова кислота |
H |
CH3 |
COOH |
H |
Хінова кислота |
H |
COOH |
COOH |
H |
Торментилова кислота |
OH |
СН3 |
COOH |
OH |
Кратегова кислота |
H |
СН3 |
OH |
H |
Хінова кислота у вільному стані та у вигляді глікозиду ß-хіновозиду міститься у корі хінного дерева Cortex Cinchonae. У кореневищах калгану Rhizomata Tormentillae досліджена близька за будовою торментилова кислота, яка утворює різні просторові ізомери. Глікозиди торментилової кислоти в експерименті виявляють гіпоглікемічну дію. Кратегова кислота з листків глоду Crataegus spp. не містить карбоксильної групи, але виявляє кислотні властивості.
ß-Амірин належить до тритерпенів типу олеанану, є одним з найпоширеніших тритерпеноїдів у рослинному світі. Цикли A/В, В/С і С/D в молекулі ß-амірину мають транс-конфігурацію, а кільця D/Е цис-конфігурацію, як у сполук типу урсану. Зустрічається у вільному стані та у вигляді ефірів з жирними кислотами. Властивий більшості рослинам, які мають молочний сік. До похідних ß-амірину належить гліциретинова кислота, яка у значній кількості міститься у коренях солодки Radices Glycyrrhizae і має протизапальні властивості.
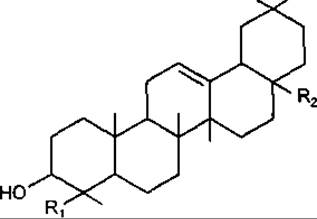
Тритерпеноїди групи олеанану
R1 = R2 = CH3 — ß-Амірин
R1 = CH3, R2 = COOH — Олеанолова кислота
R1 = CHO, R2 = COOH — Гіпсогенін
R1 = CH2OH, R2 = COOH — Гедерагенін
Олеанолова кислота зустрічається в рослинах у вільному вигляді та як аглікон сапонінів. Міститься у листках маслини Olea europea, Oleaceae, звідки отримала свою назву, а також в омелі, видах шавлії, череди, золотушника та ін.
Гіпсогенін — аглікон кислих сапонінів родини Caryophyllaceae, у значній кількості міститься у коренях мильнянки Radices Saponariae. Гедерагенін — аглікон сапонінів плюща Hedera helix, Araliaceae і насіння чорнушки Nigellasativa, Rammculaceae. Агліконову частину есцину — глікозиду з насіння каштана, складають протоесцигенін та барингтогенін, які також належать до тритерпеноїдів типу олеанану.
До окремої групи сполук належать тритерпеноїди родини Asteraceae тараксастерол, арнідіол та його просторовий ізомер фарадіол.
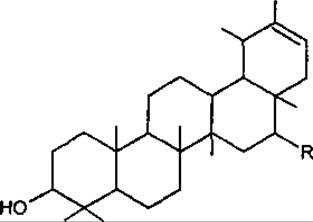
Назва сполуки |
R |
Джерело |
Тараксастерол |
Н |
Taraxacum, Cichorium, Tanacetum, Centaurea |
Арнідіол |
ОН |
Calendula, Amica |
Фарадіол |
ОН |
Taraxacum, Amica |
Кукурбітацини і лимoнoїди — тритерпенові сполуки, які складають окремі групи. Кукурбітацини обумовлюють гіркий смак рослин з родини Cucurbitaceae. Вони мають цитостатичні властивості, якщо виділені в індивідуальному стані, але дуже токсичні.
Кукурбітацин А
Лимонін
Лимоноі'ди є модифікованими тритерпенами, які ідентифіковані в родині Rutaceae і також мають гіркий смак. Одним із представників цієї групи є лимонін. Деякі лимоноїди мають протипухлинні, антимікотичні та противірусні властивості. Похідні лимоноїдів застосовують як інсектициди.
Тритерпенові сапоніни
Сапонінами (від латин. sapo — мило) називають глікозиди рослинного та тваринного походження, більша частина яких виявляє поверхневу, гемолітичну активність та токсичність по відношенню до холоднокровних тварин.
Молекули сапонінів, як і інших глікозидів, складаються з сахарної частини та аглікону, який називають сапогеніном. За типом аглікону тритерпенові сапоніни поділяють на групи дамарану, циклоартану, лупану, фріделану, урсану, олеанану та ін. Глікозиди містять один чи два вуглеводні ланцюги лінійної або розгалуженої структури. Найчастіше вуглеводний ланцюг знаходиться у положенні С-3, але зустрічаються речовини, що містять вуглеводний залишок по карбоксильній групі аглікону. У вуглеводному ланцюзі може знаходитися від 1 до 11 моносахаридів: D-глюкоза, D-галактоза, D-ксилоза, L-арабіноза, L-рибоза, D-фукоза, L-рамноза та D-глюкуронова кислота. До складу деяких глікозидів входять залишки органічних Кислот, наприклад ангелікова, тиглінова, корична, оцтова та ін.
Поширення та біологічні функції в рослинах. Сапоніни виявлено у 900 видах рослин, що відносяться до 90 родин. Тетрациклічні тритерпенові сапоніни містить обмежена група родин — Araliaceae, Cucurbitaceae та деякі ін. Пентациклічна група значно поширена в природі у рослинах 40 родин, зокрема Fabaceae, Caryophyllaceae, Asteraceae, Araliaceae, Polygalaceae, Lamiaceae тощо. З вищих спорових рослин тритерпенові сапоніни містять деякі види папоротей. Дуже рідко сапоніни трапляються в організмі тварин.
Наявність сапонінів виявлена в усіх частинах рослин, але накопичуються вони переважно у коренях, кореневищах, бульбах, плодах, значно менше в корі та наземній частині. Вміст сапонінів у різних видах рослин коливається у широких межах — від слідів до 10 % (мильне дерево — Quillaja saponaria, Rosaceae). Вміст сапонінів змінюється в залежності від періоду вегетації та кліматичних умов.
У рослинах сапоніни перебувають у вільному стані або у поєднанні з іншими речовинами. Найчастіше їх буває декілька, причому один або два домінують за кількісним вмістом. При вивченні сапонінів у рослинах були виявлені деякі особливості у їх накопиченні. Рослини, що містять велику кількість ефірної олії, звичайно бідні на сапоніни. А. Розенталер та Л. Ружичка пояснюють це тим, що ізопрен може мати два шляхи перетворення: один веде до накопичення моно- та сесквітерпенів, головних складових частин ефірної олії, а інший — до утворення ди- та тритерпенів, а потім до накопичення тритерпенових сапонінів.
Незважаючи на значне поширення тритерпенових сапонінів у природі та давнє використання їх людиною, вивчені вони недостатньо внаслідок складності хімічної і стереохімічної будови. їх досліджувало багато зарубіжних та вітчизняних вчених (Л. Ружичка із співавторами, З. Чернікова, А. Хорлін, Ю. Оводов, Г. Єляков та ін.).
Існує три точки зору на роль сапонінів у житті рослин: сапоніни — проміжна ланка між низькомолекулярними та полімерними речовинами, що містять вуглець; вони — резервні речовини (містять багато сахарів); захищають рослину (їх не поїдають комахи).
Тритерпенові сапоніни впливають на проникність рослинних клітин, що пов’язано з їх поверхневою активністю. Незначні концентрації сапонінів прискорюють, а концентровані — уповільнюють проростання насіння, ріст та розвиток рослин.
Фізико-хімічні властивості. Сапогеніни — кристалічні речовини з чіткою температурою топлення. Більшість глікозидів — аморфні речовини без чіткої температури топлення (з розкладом). У кристалічному вигляді отримано сапоніни, що містять не більш як чотири моносахариди.
Розчинність сапонінів залежить від будови і, в першу чергу, від кількості моносахаридів, що входять до їх складу. Сапоніни, що містять 2-4 сахарних залишки, розчиняються у воді погано, але із збільшенням їх кількості розчинність підвищується. Водні розчини та водні настої рослинної сировини, що містять сапоніни, при струшуванні утворюють стійку піну. Деякі сапоніни дають піну при розведенні 1:100 000. Утворення піни пояснюється тим, що сапоніни зменшують поверхневий натяг на межі двох середовищ — вода та повітря. На відміну від мильної піни, піна сапонінів має нейтральну або кислу реакцію. Властивість сапонінів утворювати стійку піну є специфічною реакцією і широко використовується для якісного і кількісного визначення їх у рослинах, але відомі сапоніни, розчини яких при струшуванні не піняться.
Сапоніни гірше розчиняються в етиловому та метиловому спиртах. При нагріванні розчинність у спиртах підвищується, але при охолодженні розчинів сапоніни випадають в осад. В ефірі, хлороформі, ацетоні та інших органічних розчинниках сапоніни не розчиняються.
Усі сапоніни нестійкі по відношенню до сильних кислот, під дією яких гідролізуються. Багато сапонінів утворюють комплекси з білками, ліпідами тощо. З холестерином утворюють нерозчинні у воді, стійкі сполуки. Найхарактернішою особливістю сапонінів є їх властивість викликати гемоліз — руйнування еритроцитів з вивільненням гемоглобіну, що пояснюється здатністю сапонінів утворювати комплекси з холестерином мембран еритроцитів. Гемолітична дія сапонінів грунтується на здатності розчиняти ліпоїдну частину оболонки еритроцитів, перетворювати її з напівпроникної у проникну. Внаслідок цього гемоглобін з еритроцитів переходить у плазму крові. Кров стає яскраво-червоною, прозорою. Сапогеніни не виявляють гемолітичної активності. Гемоліз використовувався для якісного та кількісного визначення сапонінів у рослинах.
Внаслідок гемолітичної активності сапоніни не можна вводити у вену та під шкіру.
Через непошкоджену шкіру сапоніни всмоктуються дуже повільно, що може призвести до її запалення або нагноєння. Вдихання сапонінів викликає сильне подразнення слизової оболонки верхніх дихальних шляхів та очей (чхання, кашель, сльозотеча).
Прийняття усередину малих доз шкоди не завдає, великі ж внаслідок подразнення слизової оболонки шлунково-кишкового тракту викликають блювання, пронос. Особливо токсичні сапоніни по відношенню до нижчих хребетних та риб.
Методи виділення та дослідження. Виділення Сировину знежирюють петролейним або етиловим ефіром, чотирихлористим вуглецем для руйнування нерозчинних у воді та водних спиртах комплексів сапонінів. Сумарний екстракт сапонінів звичайно отримують обробкою сировини полярними розчинниками: метанолом, етанолом, водними спиртами. Існують методи, засновані на здатності сапонінів утворювати нерозчинні у воді або водному спирті солі з гідроксидом барію або ацетатом свинцю, комплекси з холестерином, танінами, білками. Солі потім розкладають сірчаною кислотою, холестеринові комплекси — екстрагуванням холестерину бензолом або ефіром, танінові — екстракцією водною суспензією окису цинку, білкові — екстракцією сапонінів полярними органічними розчинниками.
Дуже поширені хроматографічні методи очищення сапонінів з використанням окису алюмінію, силікагелю, активованого вугілля.
Фракції сапонінів є сумішшю близьких за будовою і властивостями глікозидів, розділення їх стало можливим тільки останнім часом завдяки хроматографічним методам, але завжди є складним завданням.
Ідентифікація. Для попереднього визначення сапонінів у рослинному матеріалі користуються реакціями, які засновані на фізичних властивостях сапонінів (реакції піноутворення та визначення хімічної природи сапонінів); хімічних властивостях (осадові та кольорові реакції); біологічних властивостях (гемоліз), але вони недостатньо специфічні. Найвірогідніші результати дають хроматографічні методи виявлення та ідентифікації сапонінів. Останнім часом для дослідження сапонінів використовують фізико-хімічні методи (адсорбційна хроматографія, УФ- та ІЧ-спектроскопія).
Кількісне визначення. Для кількісного визначення сапонінів використовують біологічні, вагові та фізико-хімічні методи. Довгий час основними методами виявлення сапонінів у рослинній сировині були: визначення гемолітичного індексу та пінного числа.
Гемолітичний індекс — це найменша концентрація сапонінів, що викликає повний гемоліз еритроцитів протягом 24 год.
Показником сапонінності, або пінним числом, називають найменшу концентрацію настою (приведену до одиниці речовини), що утворює стійку піну, яка не зникає протягом хвилини. Пінне число — показник, типовий тільки при високому вмісті сапонінів у сировині. Пінність викликають і супутні речовини. Цей метод використовують для попереднього дослідження, лікарської рослинної сировини.
Вміст сапонінів можна встановити і ваговим методом. Він (грунтується на здатності сапонінів осаджуватися з водних розчинів ефіром, міцним спиртом та деякими солями (гідроксидом барію). Вагові методи не знайшли широкого застосування через складність виділення, очищення та доведення індивідуальності.
Загальних фізико-хімічних методів визначення в сировині сапонінів не існує. Те, що достовірно для одних сапонінів, не підходить для інших.
Біологічна дія та застосування. Рослинна сировина, що містить тритерпенові сапоніни, використовується в медицині, харчовій та легкій промисловості. Сапоніни мають муколітичну властивість, тому їх використовують при сухому і тривалому кашлі (китятки, синюха, первоцвіт). їх поверхнева активність полегшує відхаркування; слиз, який утворюється, під впливом сапонінів, легко відділяється. Подразнювальний вплив сапонінів на слизову оболонку шлунка викликає рефлекторне порилення секреції усіх залоз, що є цілющим і для бронхів. Але слід пам'ятати, що надлишок сапонінів подразнює слизові оболонки шлунка і кишечника.
Деякі сапоніни діють сечогінно (нирковий чай, хвощ польовий), інші тонізують центральну нервову систему або виявляють гіпотензивний, протизапальний та протимікробний ефекти. Встановлено також, що тритерпеновт сапоніни з низьким гемолітичним індексом істотно не впливають на хід атеросклерозу, але збуджують центральну нервову систему (сапоніни аралієвих). В той же час, сапоніни з високим гемолітичним індексом мають виражений лікувальний ефект при атеросклерозі.
Сапоніни сприяють розчинності, транспорту і усмоктуванню інших БАР, тому навіть мала концентрація діючих речовин у присутності сапонінів викликає терапевтичний ефект.
Емульгуючі властивості сапонінів широко використовуються для стабілізації різних дисперсних систем (емульсії, суспензії).
У біохімічних лабораторіях за допомогою сапонінів проводять кількісне визначення стеринів. Індивідуальні сапоніни використовуються для виготовлення вакцин.
У рослинництві сапоніни знайшли застосування як стимулятори проростання насіння і посилення росту клітин.
Відомості про лікувальні властивості рослинної сировини і препаратів, які містять сапоніни, наведено в табл. 14 Додатків.