ОСНОВЫ БИОХИМИИ. ХРЕСТОМАТИЯ - Г. А. Севрюкова - 2018
ГЛАВА 3. БИОХИМИЯ БЕЛКОВ: СТРОЕНИЕ, КЛАССИФИКАЦИЯ, ФУНКЦИИ
3.1. Структурные особенности белков
Белки - природные высокомолекулярные органические соединения. В XIX веке Г. Я. Мульдер обратил внимание на схожесть реакций свертывания при нагревании белка куриного яйца, крови, протоплазмы. Он сделал умозаключение, что в структурной основе всех этих веществ лежит одно и то же вещество. Й. Я. Берцелиус чисто с философских позиций называет это вещество первичной основой всего живого. Протеин в переводе с латинского языка означает первый или главный.
Белки (протеины) присутствуют во всех клетках. Для построения всех белков используется один и тот же набор различных аминокислот, ковалентно связанных друг с другом в определенной, характерной только для данного белка последовательности. Первая аминокислота, аспарагин, была открыта в 1806 году. Последней из 20 обнаруженных в белках аминокислот оказался треонин (1938 г.).
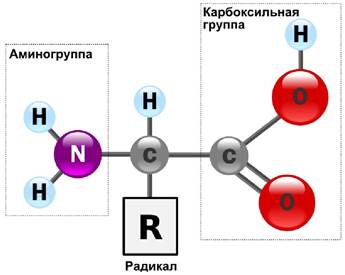
Все 20 аминокислот, встречающиеся в белках, характеризуются общей структурной особенностью - наличием карбоксильной группы и аминогруппы, связанных с одним и тем же атомом углерода (рис. 12).
Рис. 12. Обще строение аминокислот
В конце XIX века немецкий химик Эмиль Фишер начал изучение природных веществ, он расшифровывал структуры молекул, встречающихся в животных и растительных клетках. Знание структурной основы вещества необходимо для понимания его химических свойств.
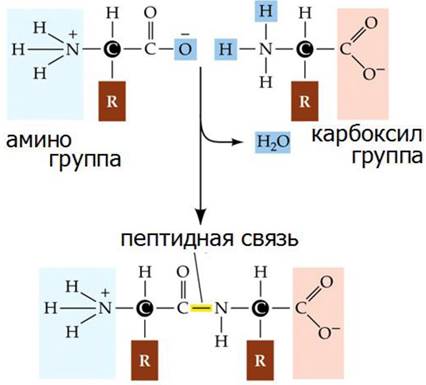
Эмиль Фишер поэтапно решал задачу о молекулярном строении протеинов. Сначала разложив протеины на природные компоненты - аминокислоты, он предположил, что последовательность соединения аминокислот в протеинах определяют их свойства, поскольку протеины состоят из нескольких тысяч аминокислот. При этом количество возможных комбинаций не ограничено. Э. Фишер создает модель «протеиноподобной» молекулы и связь между карбоксильной группой и аминогруппой с отнятием воды называет пептидной (рис. 13), и считает, что это единственная связь, соединяющая аминокислоты в белке.
Рис. 13. Образование пептидной связи
Пептидные связи простые и совершенно не зависят от радикалов, что позволяет создавать разнообразные цепочки из различных последовательностей аминокислот. Если таким способом соединить большое число аминокислот, то возникает структура, называемая полипептидом. Каждая аминокислота благодаря специфическим особенностям ее боковой цепи наделена химической индивидуальностью, поэтому всю группу из 20 аминокислот можно рассматривать как алфавит «языка» белковой структуры.
Р. Синг и А. Мартин, разработав технологию двухмерной бумажной хроматографии, смогли определить последовательность аминокислот в белке. Применив бумажную хроматографию и используя гидролизат аминокислот, сначала они на бумаге ничего не увидели, так как аминокислоты - это бесцветные вещества. Позже при помощи химического индикатора - нингидрина, образующего при взаимодействии с аминокислотами окрашенные соединения, они установили соответствие между расположением «розового пятна» на бумаге и местом той или иной аминокислоты в цепочечной последовательности. В дальнейшем это позволило проводить аналитический микроанализ состава белков.
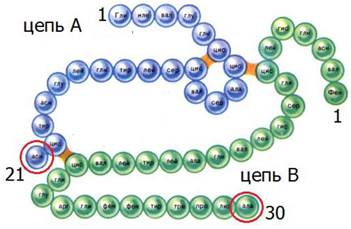
Инсулин стал первым полипептидом, для которого была полностью определена первичная структура. За проделанную работу в 1958 году Ф. Сенгер был удостоен Нобелевской премии по химии. Общая формула инсулина (C337N65O75S6) имеет три сульфидных мостика и состоит из двух цепей: цепь A (содержит 21 аминокислотный остаток) и цепь B(содержит 30 аминокислотных остатков) (рис. 14).
Рис. 14. Строение молекулы инсулина
Классификация аминокислот основана на признаках, свойственных их R-группам, т. е. способности R-групп к взаимодействию с водой при биологических значениях рН близких к 7,0.
Функциональные свойства полипептида определяет последовательность аминокислот.
По степени полярности все R-группы аминокислот можно расположить в виде непрерывного ряда, начиная от полностью неполярных (гидрофобных) R-групп и заканчивая полярными (гидрофильными) R-группами. Выделяют четыре основных класса аминокислот:
1) неполярные или гидрофобные;
2) полярные или гидрофильные (незаряженные);
3) полярные или гидрофильные (отрицательно заряженные);
4) полярные или гидрофильные (положительно заряженные).
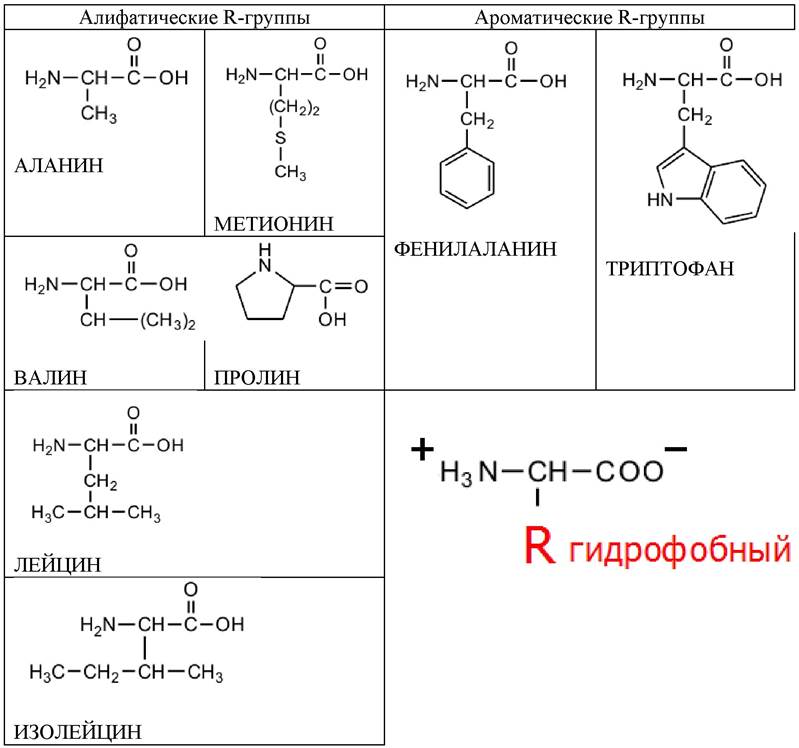
Восемь аминокислот содержат неполярные R-группы (табл. 2):
✔ пять аминокислот с алифатическими R-группами;
✔ две аминокислоты с ароматическими кольцами;
✔ одна аминокислота содержит серу.
Таблица 2. Аминокислоты, содержащие неполярные или гидрофобные R-группы (незаряженные)
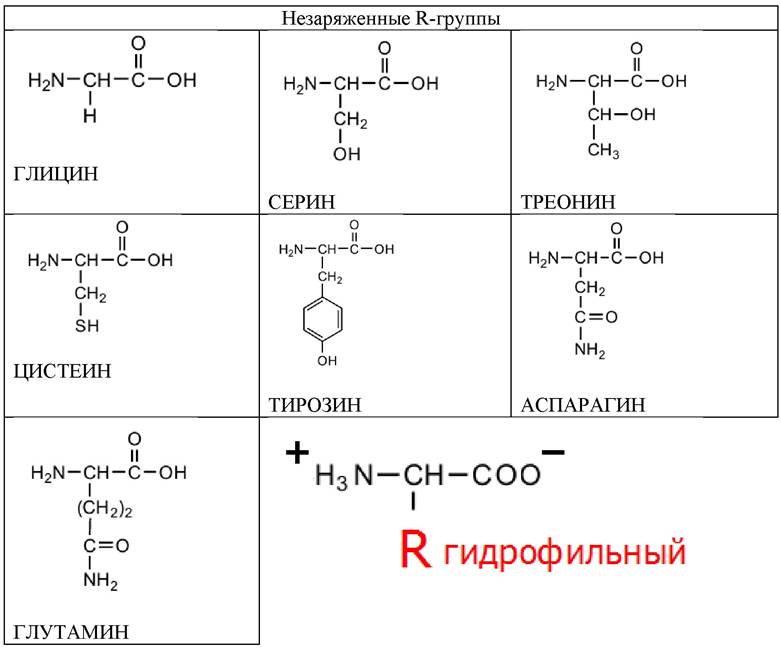
Семь аминокислот содержат полярные незаряженные R-группы. Эти аминокислоты лучше растворяются в воде, т. е. они более гидрофильны, чем неполярные аминокислоты, их функциональные группы образуют водородные связи с молекулами воды (табл. 3).
Таблица 3. Аминокислоты, содержащие полярные или гидрофильные R-группы (незаряженные)
Две аминокислоты содержат полярные отрицательно заряженные (кислые) R-группы. Каждая аминокислота содержит вторую карбоксильную группу и при рН 7 несет суммарный отрицательный заряд.
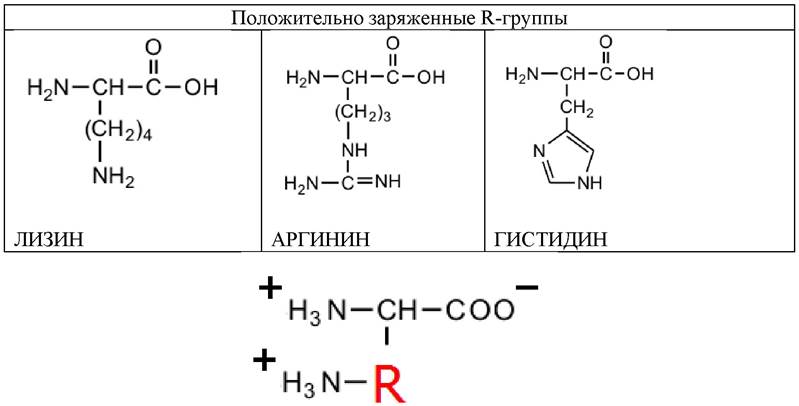
Три аминокислоты содержат полярные положительно заряженные (основные) R-группы. Эти аминокислоты содержат или вторую аминогруппу, или имидазольную группу, и при рН 7 несут суммарный положительный заряд (табл. 4; 5).
Таблица 4. Аминокислоты, содержащие полярные или гидрофильные R-группы (отрицательно заряженные)
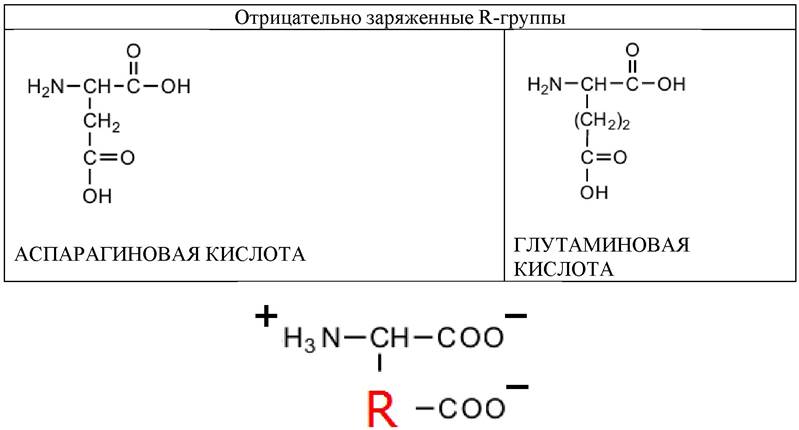
Таблица 5. Аминокислоты, содержащие полярные или гидрофильные R-группы (положительно заряженные)
3.2. Основные представители полипептидов (белков)
Выделяют несколько основных классов белков в соответствии с их биологическими функциями.
Самый многообразный и наиболее высокоспециализированный класс белков составляют ферменты - белки, обладающие каталитической активностью. Почти все химические реакции с участием органических биомолекул катализируются ферментами.
Транспортные белки, например, гемоглобин, содержащийся в эритроцитах, связывает кислород (оксигемоглобин) и доставляет его к периферическим тканям, где кислород высвобождается и используется для окисления компонентов пищи - процесса, в ходе которого производится энергия. Присоединив CO2, гемоглобин становится карбгемоглобином и способствует выведению углекислого газа из организма через систему дыхания.
В семенах многих растений (пшеница, кукуруза, рис) запасены пищевые белки, потребляемые на первых стадиях развития зародыша.
Некоторые белки наделяют клетку или организм способностью сокращаться, изменять форму или передвигаться (сократительные белки). Актин и миозин представляют собой нитевидные белки, функционирующие в сократительной системе скелетной мышце.
Многие белки образуют волокна (структурные белки). Они выполняют опорную функцию, скрепляя биологические структуры и придавая им прочность. Коллаген является компонентом хрящей и сухожилий, эластин - связок; кератин - волос, ногтей, перьев.
Защитные белки. Иммуноглобулины обладают способностью распознавания и нейтрализации чужеродных бактерий, вирусов. Фибриноген и тромбин - белки свертывания крови. Они предохраняют организм от потери крови при повреждении сосудистой системы.
Регуляторные белки. Некоторые белки участвуют в системе регуляции клеточной или физиологической активности. Инсулин регулирует обмен глюкозы. Паратиреоидный гормон регулирует транспорт ионов кальция и фосфатов.
Белки могут быть разбиты на два больших класса в соответствии с формой их молекул: глобулярные и фибриллярные (рис. 15).
Рис. 15. Формы белковых молекул
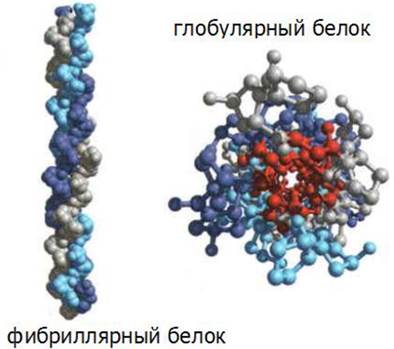
В глобулярных белках полипептидные цепи свернуты в плотную компактную структуру сферической формы. Г лобулярные белки растворимы в водных системах.
Фибриллярные белки представляют собой нерастворимые в воде длинные нитевидные молекулы.
Существует взаимосвязь между аминокислотной последовательностью, биологической активностью и видоспецифичностью белков. Однако характеристика белков далеко не исчерпывается их первичной структурой - так обычно называют ковалентную структуру белка и его аминокислотную последовательностью. Белки в их естественном состоянии носят название нативных белков. Изменения, происходящие с белками при нагревании, в совокупности называются денатурацией и соответственно белки после денатурации - денатурированные белки.
Вследствие денатурации белок утрачивает характерную для него биологическую активность: он становится нерастворимым и не обладает каталитической активностью.
Установлено, что денатурация не сопровождается разрывом ковалентных связей в полипептидной цепи, но биологическая активность утрачивается. Следовательно, помимо первичной структуры, белки обладают более высокими уровнями структурной организации.
Простейшая форма полипептидной цепи, содержащая жесткие пептидные связи, вокруг которых вращение невозможно - это спиральная структура, которую Л. Полинг и Р. Кори назвали α-спиралью (рис. 16).
Рис. 16. Структурная организация α-спирали
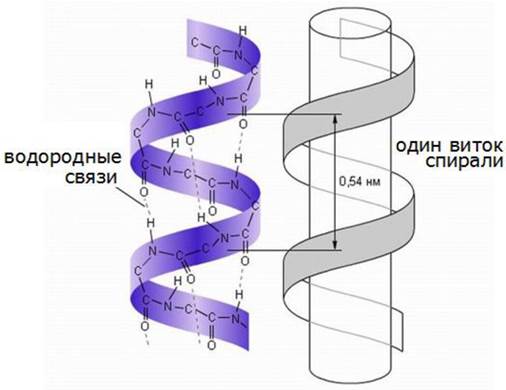
В этой структуре полипептидный остов образует плотные витки вокруг длинной оси молекулы, тогда как R-группы аминокислотных остатков выступают из спирального остова наружу. Шаг витка спирали соответствует 0,54 нм. Такая конформационная структура полипептидной цепи допускает образование водородных связей между каждым атомом водорода, соединенным с электроотрицательным атомом азота пептидной связи и электроотрицательным атомом кислорода карбоксильной группы четвертого аминокислотного остатка. Таким образом, каждый последующий виток связан с предыдущим несколькими водородными связями, что придает всей структуре устойчивость.
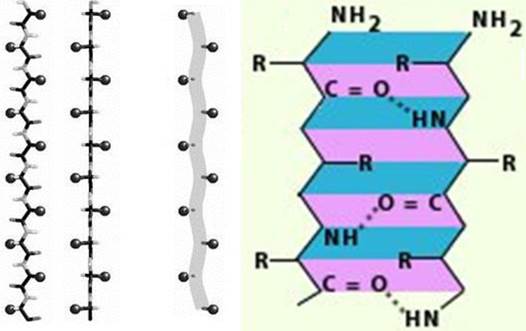
Пространственное расположение, т. е. конформация, соседних аминокислотных остатков в полипептидной цепи - это вторичная структура белка. Помимо α-конформации существует β-конформация, которая предполагает не спиральную форму свертывания полипептидной цепи, а зигзагообразную структуру (рис. 17), когда водородные связи связывают параллельно уложенные полипептидные цепи.
Рис. 17. Структурная организация β-спирали
К категории нитевидных нерастворимых белков (фибриллярные белки) относят α и β-кератины, коллаген, эластин.
α-Кератин - основной элемент структуры волоса. Полипептидная цепь α-кератина имеет α-спиральную конформацию. Три α-спиральные цепи образуют скрученный трехжильный канат, а 11 таких канатов составляют микрофибриллу волоса.
Пример биохимической технологии: α-кератины, из которых состоят наши волосы, при нагревании в увлажненном состоянии могут растягиваться и принимать β-конформацию, но при остывании они самопроизвольно возвращаются в α-спиральную конформацию. Это свойство а-кератинов наряду с высоким содержанием в них дисульфидных поперечных связей лежит в основе перманентной завивки волос. Сначала волосы накручивают на бигуди, затем смачивают восстанавливающим агентом, который при нагревании разрывает водородные и дисульфидные связи (восстанавливая цистеин, превращающийся в два остатка цистеина) - α-спираль раскручивается. Через некоторое время восстанавливающий раствор смывают, и волосы обрабатывают окисляющим раствором, который способствует образованию новых дисульфидных связей. В конечном итоге волосы приобретают желаемую форму вьющихся прядей.
β-Кератины, в частности фиброин (белок шелка и паутины) отличаются от α-кератинов тем, что имеют другую периодичность конформационной структуры, элементы которой повторяются через каждые 0,70 нм β-конформации.
Для β-конформации характерно отсутствие внутрицепочечных водородных связей. Вместо них образуются межцепочечные водородные связи между пептидными группами соседних полипептидных цепей.
В β-кератинах нет поперечных цистеиновых связей между соседними цепями и соседние полипептидные цепи обычно направлены в противоположную сторону, т. е. имеют антипараллельную ориентацию, тогда как для α-кератина характерна параллельная ориентация.
Коллаген, эластин и протеогликаны - главные фибриллярные белки соединительных тканей. Сухожилия, связки, хрящи и органический матрикс костей - это наиболее знакомые элементы соединительной ткани.
Коллагеновая соединительная ткань состоит из волокон, которые в свою очередь состоят из коллагеновых фибрилл, характеризующихся поперечнополосатой структурой. Фибриллы коллагена могут выдерживать нагрузку, вес которой в 10000 раз превышает их собственный вес, т. е. по прочности они превосходят стальную проволоку равного поперечного сечения.
При кипячении в воде волокнистый, нерастворимый коллаген превращается в желатину - растворимую смесь полипептидов, которую в кулинарии используют для приготовления желе. Ковалентные связи коллагена - одна из главных причин, по которой мясо необходимо подвергать тепловой обработке, так как коллаген соединительной ткани и сосудов делает мясо жестким.
Коллагены содержат около 3 5 % остатков глицина, 11 % - аланина и около 21 % - пролина и 4-гидроксипролина.
Нарушения синтеза коллагена лежат в основе таких заболеваний как коллагенозы. Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы. Помимо наследственных факторов коллагенозы могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена - дефицитом ферментов гидроксилирования, т. е. нарушается процесс преобразования пролина в 4-гидроксипролин.
Многие морские путешествия, особенно в полярные страны, изобилуют фактами трагической гибели моряков. Мореплаватели гибли от странной и страшной болезни: у них распухали и кровоточили десны, расшатывались и выпадали зубы, опухали и болели суставы, тело покрывалось темными пятнами. Эта болезнь была названа цингой, а следствием этой болезни становились еще и коллагенозы.
Стали замечать, что болезнь быстро исчезала, как только корабль приставал к земле, где было вдоволь свежих овощей и плодов, на которые с жадностью набрасывались матросы. В 1795 году английский парламент издал закон о ежедневной выдаче экипажам кораблей порции лимонного сока. Оказалось, что аскорбиновая кислота, содержащаяся в цитрусовых плодах, является необходимым участником гидроксилирования пролинов.
Как правило, на каждом третьем месте в полипептидной цепи коллагена стоит глицин: гли-про-ала-гли-про-про. С возрастом в тропоколлагеновых субъединицах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена более жесткими и хрупкими.
Фибриллы коллагена не растягиваются, тогда как для фибрилл эластина характерна высокая степень растяжимости (рис. 18).
Рис. 18. Структурная форма коллагена и эластина
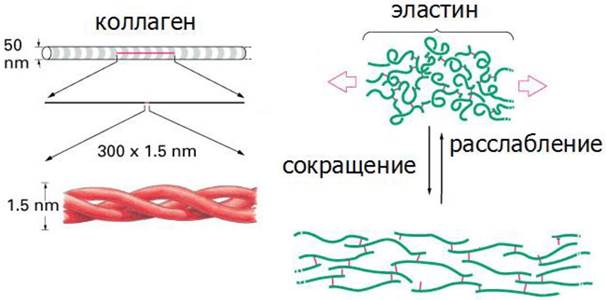
К основным типам соединительной ткани, богатой эластином относится желтая эластическая ткань связок и эластический слой соединительной ткани в стенках крупных артерий. Основная субъединица фибрилл эластина - тропоэластин. Подобно коллагену, эластин богат глицином и аланином, но отличается тем, что содержит много остатков лизина и мало про- лина. Четыре R-группы лизина сближаются друг с другом и ферментативным путем превращаются в десмозин. Таким путем полипептидные цепи тропоэластина могут объединяться в системы, способные растягиваться во всех направлениях (рис. 18).
Протеогликаны выполняют функцию основного вещества, в которое погружены волокнистые элементы соединительной ткани. Протеогликаны играют также роль межтканевых прослоек и служат смазочным материалом в суставах.
К категории белков, полипептидная цепь которых свернута в компактную глобулу (глобулярные белки) относят почти все известные на сегодняшний день ферменты. К классу глобулярных белков принадлежат антитела, гормоны, а также компоненты мембран и рибосом.
Полипептидные цепи глобулярных белков компактно свернуты в сферическую глобулу (третичная структура), благодаря чему и возникает их биологическая активность. Глобулярные белки отличаются по строению трехмерной структуры в соответствии с их совершенно разными биологическими функциями.
Первый значительный успех в изучении трехмерной структуры глобулярных белков принадлежит Д. Кендрью (Англия, 1950 г.) в результате рентгеноструктурного исследования миоглобина.
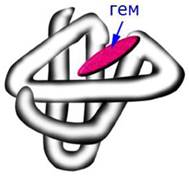
Миоглобин - это кислород-связывающий белок, который присутствует в мышечных клетках. Он запасает связанный кислород и способствует его переносу в митохондрии. В молекуле миоглобина имеется одна полипептидная цепь, состоящая из 153 аминокислотных остатков и одна гемогруппа - комплекс протопорфирина с железом (рис. 19).
Рис. 19. Третичная структура миоглобина
Третичную структуру имеют цитохром С - участвующий в транспорте электронов по дыхательной цепи; рибонуклеаза - фермент, который катализирует гидролиз некоторых связей в молекулах рибонуклеиновых кислот. Рентгеноструктурный анализ цитохрома С показал, что 40 % остатков приходится на долю α-спиралей, тогда как в миоглобине 80 % аминокислотных остатков содержатся в α-спиральных сегментах. В целом третичная структура цитохрома С имеет всевозможные изгибы, повороты, нерегулярные витки. В третичной структуре рибонуклеазы очень мало α-спиральных участков, но зато имеется большое число сегментов, находящихся в β-конформации и четыре остатка цистина, образующих дисульфидные связи между петлями полипептидной цепи.
Существуют связи, стабилизирующие третичную структуру белков:
✔ дисульфидные связи между радикалами двух молекул цистеина (ковалентные поперечные связи);
✔ водородные связи между полярными (гидрофильными) R-группами;
✔ электростатические силы притяжения между R-группами, которые несут противоположно заряженные ионогенные группы (ионные связи);
✔ гидрофобные взаимодействия между неполярными (гидрофобными) R-группами.
Вторичная структура белка определяется последовательностью R-групп в близких участках цепи, тогда как третичная структура зависит от аминокислотной последовательности далеко расположенных друг от друга участков цепи.
Олигомерными называются белки, содержащие две или большее число полипептидных цепей. К самым известным олигомерным белкам относится гемоглобин, содержащий четыре полипептидные цепи и четыре простетические гемогруппы, в которых атомы железа находятся в закисной форме [Fe(II)].
Белковая часть молекулы - глобин - состоит из двух α-цепей (по 141 остатку в каждой) и двух β-цепей (по 146 аминокислотных остатков) (рис. 20).
Рис. 20. Четвертичная структура молекула гемоглобина
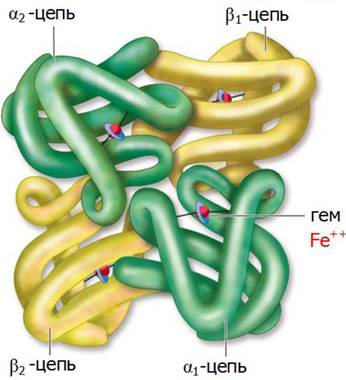
В олигомерных белках каждая из полипептидных цепей, образующая субъединицу, характеризуется своей вторичной и третичной пространственной структурой. При этом упаковка полипептидных цепей, входящих в состав отдельных субъединиц, образует четвертичную структуру нативной конформации белка.
Основным свойством белка, обеспечивающим его функцию, является избирательное взаимодействие с определенным веществом - лигандом. На белковых молекулах есть участки - активные центры, к которым присоединяются лиганды. Высокая специфичность взаимодействия («узнавания») белка и лиганда обеспечивается комплементарностью структуры активного центра и лиганда.
Под комплементарностью понимают химическое и пространственное соответствие активного центра белка и лиганда.
Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных от активного центра. Такие центры называются аллостерическими, а лиганды, способные с ними взаимодействовать - аллостерическими лигандами.
Лиганд, взаимодействующий с белком и нарушающий его биологическую функцию, называют ингибитором. Ингибиторы конкурируют с естественным лигандом за активный центр в белковой молекуле или ферменте.
Гемоглобин состоит из четырех протомеров (полипептидных цепей). Основная функция гемоглобина - транспорт кислорода от легких к тканям.
Клетки нашего организма получают энергию с использованием кислорода. Из-за больших расстояний между внешней средой и клетками требуются специальные системы транспорта для доставки к клеткам кислорода (О2) и удаления из клеток углекислого газа (СО2), образующегося в результате окислительного обмена веществ.
Связывание кислорода с атомом железа первого протомера вызывает перемещение атома железа в плоскости гема (рис. 21), а это, в свою очередь, вызывает перемещение остатка гистидина, который связан с атомом железа. Изменение положения гистидина приводит к разрыву некоторых слабых связей в первом протомере, вследствие чего изменяется его конформация. Поскольку все протомеры связаны между собой, то также изменяется конформация и второго, и третьего, и четвертого протомера. Конформационное изменение облегчает взаимодействие протомеров с кислородом (кооперативный эффект). В результате чего присоединение четвертой молекулы кислорода происходит в 300 раз легче, чем первой.
Рис. 21. Взаимодействие гемоглобина с кислородом: А - изменение конформации протомера гемоглобина при взаимодействии с О2, Б - кооперативный эффект при взаимодействии гемоглобина с О2
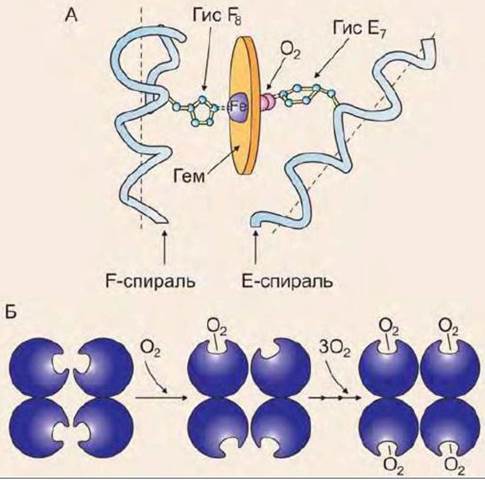
При освобождении кислорода четвертичная структура вновь принимает исходную форму, способствующую связыванию СО2 и ионов Н+.
Пептиды, содержащие до 10 аминокислотных остатков, называются олигопептидами (трипептид, пентапептид, октапептид). Пептиды, состоящие из более чем 10 аминокислотных остатков, называются полипептидами. Полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками.
3.3. Структурные особенности ферментов. Механизм действия ферментов
В 1897 году Э. Бюхнер прессованием растертых дрожжей получил сок, который не содержал клеток, но был способен вызывать спиртовое брожение. Подобные опыты утвердили представление о том, что в живых клетках содержатся вещества, катализирующие определенные реакции, и что эти вещества можно выделить из клеток и изучать методами химии.
Д. Самнер, пришедший в биохимию только потому, что во время спортивных состязаний у него произошел несчастный случай, и он остался без руки, в 1926 году получив задание в биохимической лаборатории Cornell University, поставил следующий эксперимент. Он из соевой муки выделяет фермент уреазу, расщепляющую мочевину. Самнер, не владея всеми тонкостями выделения ферментов на адсорбентах, берет соевую муку и в большом сосуде разводит ее водой. Многократно фильтруя, он получает водный раствор экстракта, который заливает холодным ацетоном и, будучи человеком беспечным, ставит «все это дело» на лед и уходит. На следующий день он видит «волшебную картину», раствор «играет», преломляет свет, так как в нем образовались кристаллы, которые были не чем иным как чистым веществом - уреазой. Сделав анализ, Д. Самнер высказывает предположение, что все ферменты представляют собой белки.
Ферменты - это группа белков, обладающих способностью к ускорению химических реакций. Ферменты отличаются от других катализаторов уникальными свойствами, а именно: высокой эффективностью действия, специфичностью действия и способностью к регуляции.
Название всех ферментов имеет окончание «аза», к которому добавлено название субстрата, подвергающегося действию данного фермента. Например, глутаминаза - фермент, катализирующий гидролиз глутамина. Помимо названия субстрата в названии фермента может быть использовано и действие, которое фермент оказывает. Например, глутамат дегидрогеназа - фермент, катализирующий дегидрирование глутаминовой кислоты. Некоторые ферменты сохранили тривиальные названия: пепсин, трипсин.
В соответствии с типами катализируемых реакций все ферменты разделены на шесть классов, а сложным ферментам присваивают кодовый номер, где первая цифра обозначает класс, вторая цифра - подкласс, третья цифра - подподкласс и четвертая цифра - порядковый номер в подподклассе. Например, гексоза-6 фосфотрансфераза (катализирует перенос фосфатной группы с АТФ на гексозу) имеет следующий порядковый номер - 2.7.1.1.
Шесть классов, на которые разделены ферменты, включают: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы.
Оксидоредуктазы - катализируют с участием двух субстратов окислительно-восстановительные реакции в основе биологического окисления. Различают следующие основные оксидоредуктазы: аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.
Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот. Например, метил- и формилтрансферазы, ацетилтрансферазы, аминотрансферазы, фосфотрансферазы.
Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. К ним относятся: эстеразы - ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; амидазы, ускоряющие разрыв амидных связей, отличных от пептидных связей.
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С-О, С-С, С-N, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Например, фумарат-гидратаза катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбоксилиазы), амидин-лиазы.
Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза».
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата).
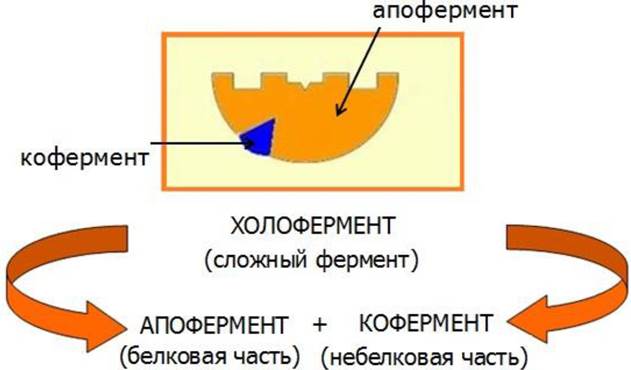
Все ферменты относятся к глобулярным белкам. Активность многих ферментов проявляется только в присутствии небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части - апофермента и кофактора называется холоферментом (рис. 22). Роль кофактора могут выполнять ионы металлов или органические соединения, которые обычно называют коферментами.
Рис. 22. Строение холофермента
Кофакторы (коферменты) в ходе биохимических реакций выполняют следующие функции (табл. 6):
✔ участвуют в формировании третичной структуры белка и обеспечении комплементарности между ферментом и субстратом;
✔ У могут непосредственно вовлекаться в реакцию в качестве еще одного субстрата, выступая в качестве донора или акцептора определенных химических групп.
Таблица 6. Коферменты и их основные функции
Кофермент-предшественник |
Функция |
Витамин |
NAD+; NADP+ |
Перенос водорода (электронов) в окислительновосстановительных реакциях |
Никотиновая кислота - витамин РР |
FAD |
Перенос водорода (электронов) в окислительновосстановительных реакциях |
Рибофлавин - витамин В2 |
Кофермент А |
Активация и перенос ацильных групп в реакциях, катализируемых лигазами и трансферазами |
Пантотеновая кислота |
Биотин |
Связывание СО2, активация и включение в молекулы (класс лигазы) |
Биотин - витамин Н |
Пиридоксальфосфат |
Перенос аминогрупп и де- карбоксилирование аминокислот (класс трансферазы, лиазы) |
Пиридоксин - витамин В6 |
Тетрагидрофолиевая кислота |
Перенос одноуглеродных фрагментов (класс трансферазы) |
Фолиевая кислота |
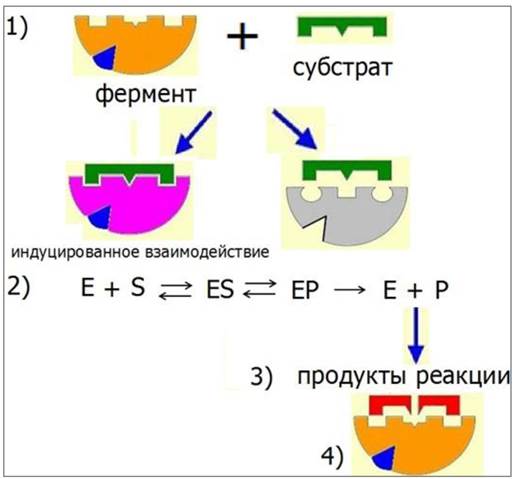
Механизм действия ферментов включает следующие этапы (рис. 23):
1. Специфическое связывание фермента с лигандом - субстратом происходит в области активного центра, который формируется за счет сближения радикалов, определенным образом ориентированных в пространстве. У сложных ферментов в активном центре расположен кофактор. Одни R-группы активного центра принимают участие в связывании субстрата, другие - в катализе.
2. Связывание субстрата с ферментом вызывает конформационные изменения, увеличивая специфичность фермент-субстратного взаимодействия - индуцированное взаимодействие.
3. Образование продуктов реакции.
4. Освобождение продуктов реакции и переход фермента в исходное состояние.
Рис. 23. Механизм действия ферментов
Максимальная активность фермента наблюдается при оптимальных условиях протекания реакции. Например, ферменты желудочного сока действуют только при температуре 37 °С и в кислой среде, поэтому во время приема пищи в желудке сначала выделяется соляная кислота, а затем активируются ферменты; ферменты слюны активны в слабощелочной среде. Изменение рН приводит к изменению степени ионизации ионогенных групп фермента и, следовательно, ведет к перераспределению межрадикальных связей. Это изменяет конформацию фермента и нарушает комплементарное соответствие активного центра и субстрата.
Изменение температуры вызывает двоякий эффект: с одной стороны, при повышении температуры до 37 °С скорость ферментативной реакции увеличивается в связи с повышением кинетической энергии реагирующих молекул; с другой стороны, при температуре выше 40 °С начинается денатурация фермента и скорость реакции снижается.
Энергией активации называется количество энергии в калориях, необходимое для того, чтобы все молекулы 1 моля вещества при определенной температуре достигли переходного состояния, которое соответствует вершине энергетического (активационного) барьера. Вершина активационного барьера - это точка вероятности вступления молекул субстрата в реакцию с образованием конечного продукта реакции. Скорость любой химической реакции пропорциональна концентрации молекул, находящихся в переходном состоянии.
Существуют два основных пути повышения скорости химической реакции. Первый путь - повышение температуры (повышение температуры на 10 °С вызывает ускорение химической реакции приблизительно в 2 раза) и второй путь - добавление фермента, обладающего соответствующей каталитической активностью.
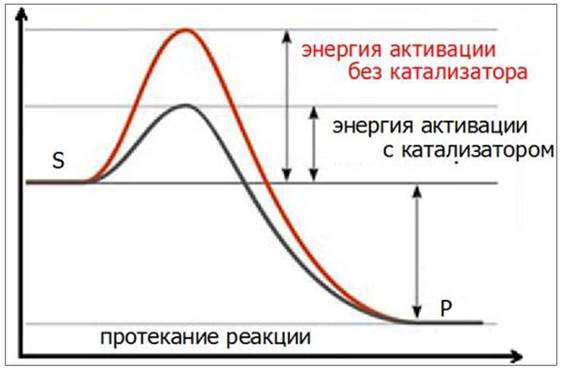
Ферменты ускоряют химические реакции, находя «обходные пути», позволяющие молекулам субстрата преодолевать активационный барьер на более низком энергетическом уровне (рис. 24).
Рис. 24. Действие фермента-катализатора в процессе протекания химической реакции: S - субстрат, Р - продукт
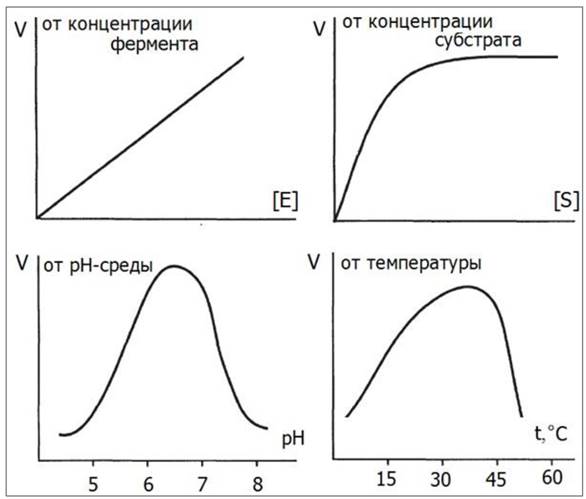
Скорость ферментативных реакций измеряют по убыли субстрата или по приросту продукта за единицу времени. Изменение скорости ферментативной реакции находится в прямой пропорциональной зависимости от концентрации фермента (рис. 25). Если концентрация фермента постоянна, то зависимость скорости реакции от концентрации субстрата на графике имеет вид гиперболы и напоминает кривую насыщения белка лигандом.
На графике также показана зависимость скорости реакции от температуры и рН-среды.
Рис. 25. Зависимость скорости биохимической реакции от концентрации субстрата, концентрации фермента, рН-среды и температуры
Лиганд, взаимодействующий с ферментом и нарушающий его функцию, называют ингибитором.
Существуют ингибиторы двух основных типов: необратимые и обратимые.
Необратимые ингибиторы разрушают функциональную группу молекулы фермента, необходимую для проявления его каталитической активности. Примером необратимого ингибитора служит соединение диизоприлфторфосфат (ДФФ), которое ингибирует ацетилхолинэстеразу, играющую важную роль в передаче нервных импульсов. ДФФ - это отравляющее вещество нервнопаралитического действия.
Обратимые ингибиторы представлены двумя видами: конкурентные и неконкурентные.
Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром, но в отличие от субстрата конкурентный ингибитор не подвергается ферментативному превращению. Повысив концентрацию субстрата, конкурентный ингибитор можно устранить. Примером конкурентного ингибитора служит дитилин, применяемый в медицине как миорелаксант для расслабления мышц при кратковременных операциях.
В случае неконкурентного ингибирования ингибитор присоединяется к ферменту не в активном центре, где связывается субстрат, а в другом месте, что приводит к конформации молекулы фермента и инактивации его каталитической активности.
В живой клетке скорость ферментативных реакций находится под строгим контролем, что позволяет каждой метаболической цепочке реакций постоянно изменять свою скорость, приспосабливаясь к меняющимся условиям среды и потребностям клетки в продукте.
3.4. Структурные особенности нуклеиновых кислот и их роль в передаче наследственной информации
Нуклеиновые кислоты - сложные высокомолекулярные соединения, имеющиеся во всех клетках живых организмов. Нуклеиновые кислоты играют ведущую роль в хранении и в передаче наследственной информации. Нуклеиновые кислоты были открыты в середине 60-х годов XIX века швейцарским ученым Фридрихом Мишером.
Термин «нуклеиновые кислоты» был предложен в 1889 году. Нуклеиновыми они были названы потому, что впервые были открыты в ядрах клеток, а кислотами - из-за наличия в их составе остатков фосфорной кислоты. Лишь к концу 30-х годов XX века был уточнен химический состав нуклеиновых кислот, а также установлено, что имеется два типа нуклеиновых кислот — дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). В зависимости от выполняемой функции в клетке выделяют три основных вида РНК:
1) матричные или информационные РНК;
2) транспортные РНК являются молекулами в виде «клеверного листа», у которых с одной стороны присоединяется аминокислота, с другой они присоединяются к мРНК;
3) рибосомные РНК.
В геноме (совокупности всех молекул ДНК клетки) зашифровано строение всех белков и молекул данного организма. В процессе синтеза ДНК (репликации) количество информационного материала удваивается и при делении поступает в дочерние клетки.
Репарация исправляет изменения в генетическом материале, происходящие в ходе рекомбинаций (обмена генетическим материалом между хромосомами) и нарушения в структуре ДНК.
Наследственная информация передается от ДНК через РНК на белок (рис. 26). Реализация этой информации в клетках включает процессы транскрипции или синтеза РНК и трансляции или синтеза белка.
Рис. 26. Передача наследственной информации
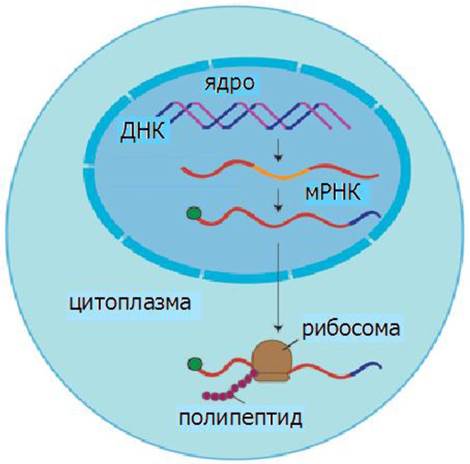
В ядре в процессе транскрипции синтезируются матричные, транспортные и рибосомные РНК, необходимые для синтеза белка.
В ходе трансляции информация о структуре белка, переписанная с ДНК на мРНК, с помощью тРНК переводится в аминокислотную последовательность белков. Матричная природа синтеза нуклеиновых кислот и белков обеспечивает точность воспроизведения информации.
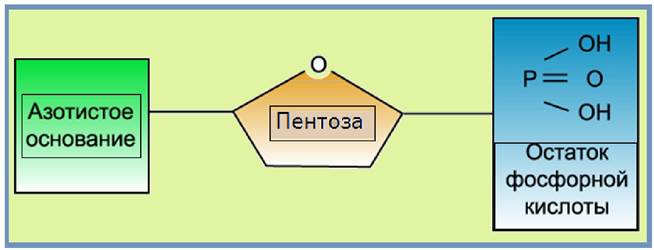
ДНК и РНК - это полимеры, построенные из нуклеотидов. Каждый нуклеотид состоит из трех компонентов: азотистого основания, пентозы и остатка фосфорной кислоты (рис. 27).
Рис. 27. Строение нуклеотида
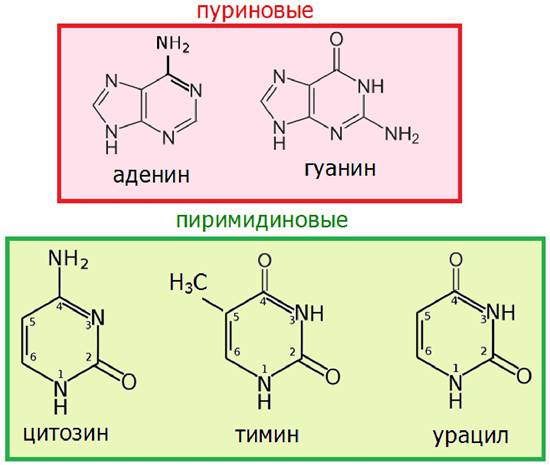
Азотистые основания представлены двумя производными пурина: аденин и гуанин, и тремя производными пиримидина: цитозин, тимин (в ДНК) и урацил (в РНК) (рис. 28).
Рис. 28. Строение азотистых оснований
В состав нуклеиновых кислот в циклических P-формах входят дезоксирибоза (в ДНК) и рибоза (в РНК) (рис. 29, 30).
Рис. 29. Строение рибозы и дезоксирибозы
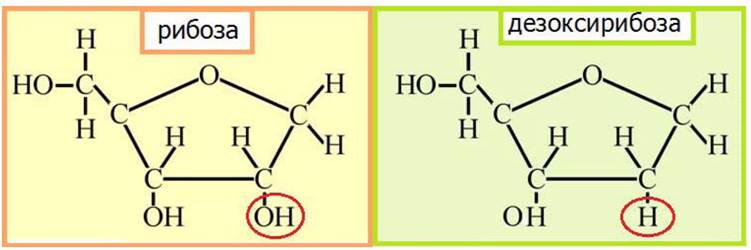
Рис. 30. Фрагмент полимерной цепочки РНК
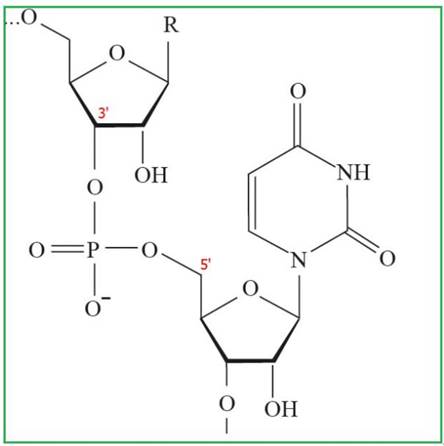
Первичная структура нуклеиновых кислот - это порядок чередования нуклеотидов в полинуклеотидной цепи, связанных между собой 3', 5' - фосфодиэфирной связью. В результате образуются полимеры с фосфатным остатком на 5'-конце и свободной - ОН группой пентозы на 3'-конце.
Вторичная структура ДНК представлена правозакрученной спиралью, в которой две полинуклеотидные цепи расположены антипараллельно и удерживаются относительно друг друга за счет взаимодействия между комплементарными, азотистыми основаниями. По правилу комплементарности оснований аденин соответствует тимину, а цитозин - гуанину.
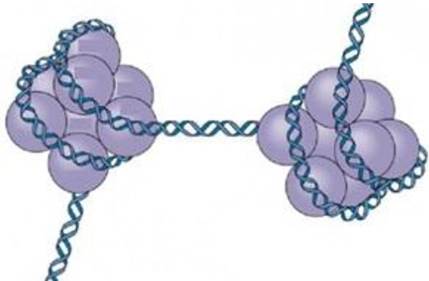
Третичная структура ДНК формируется в результате ее взаимодействия с белками, благодаря чему ДНК упаковывается в отдельную хромосому (рис. 31).
Рис. 31. Третичная структура ДНК (формирование хромосом)
Для краткого изображения последовательности нуклеотидов в нуклеиновых кислотах пользуются однобуквенным кодом. При этом запись осуществляется слева направо, так что первый нуклеотид имеет свободный 5'- фосфатный конец, а последний - ОН-группу в 3'-положении рибозы или дезоксирибозы. Например, первичная структура ДНК может иметь следующий вид: CGNAAGTTCG...