Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Масс-спектрометрия электронного удара
Фрагментации первичных молекулярных ионов пептидов
Фрагментация полученных электронным ударом первичных молекулярных ионов перметилированных ацетилпептидов обусловлена, в основном, разрывом амидных связей - С-N с фиксацией заряда на карбонилсодержащем ионе (фрагменте или осколке). Это ион b (см. схему). Этот тип распада идет часто двухступенчато с выбросом СО и образованием альдиминных фрагментов (ионов с).
Образовавшиеся в результате фрагментации осколочные ионы как раз и характеризуют аминокислотную последовательность пептида. Разности масс осколочных ионов отвечают величинам масс аминокислотных остатков.
Схема процесса фрагментации первичного молекулярного иона выглядит так:
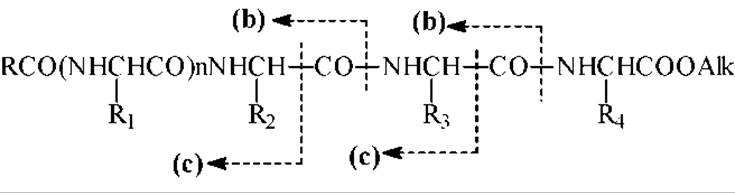
Для расшифровки масс спектра пептида находят вначале в нем пик, отвечающий иону N-концевой аминокислоты. Его массовое число лежит в интервале m/z = 114-257. Затем находят разность массовых чисел следующих друг за другом (стоящих рядом) пиков осколочных ионов и пользуясь таблицей масс модифицированных аминокислотных остатков (см ниже) определяют какая именно аминокислота отщепилась от осколочного иона в процессе фрагментации. Рассмотрим это на конкретном примере. Пусть мы имеем пептид A-B-C-D, где A,B,C,D - остатки модифицированных аминокислот. При ЭУ и в результате фрагментации образуются следующие ионы: A+, AB+, ABC+, ABCD+. Пользуясь данными приведенной ниже таблицы массовых чисел комбинируем аминокислотную последовательность исходя из реального масс-спектра.
Аминокислоты с R-остаками общей формулы CH2X, в которых Х содержит двойные связи, склонны при ЭУ к разрыву связей C-N с миграцией атома водорода:
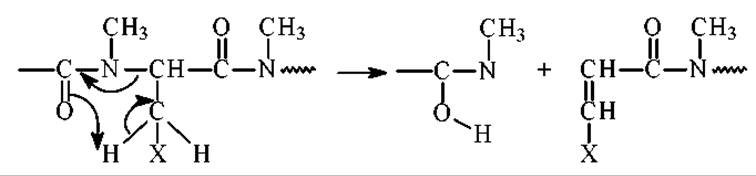
Такой распад характерен для пептидов с остатками аспарагиновой кислоты, аспарагина, фенилаланина, гистидина, тирозина и триптофана. При фрагментации образуются новые пептиды.
Таблица Массы ионов N-концевых и прочих аминокислотных (а/к) остатков в масс-спектрах ЭУ ацетилированных перметилпептидов
А/к |
Масса N-конц. а/к |
Масса а/к остатка |
А/к |
Масса N-конц. а/к |
Масса а/к остатка |
Гли |
114 |
71 |
Мет |
188 |
145 |
Ала |
128 |
85 |
Асн |
199 |
156 |
Про |
140 |
97 |
Глу |
200 |
157 |
Вал |
156 |
113 |
Фен |
204 |
161 |
Сер |
158 |
115 |
Гис |
208 |
165 |
Лей |
170 |
127 |
Глн |
213 |
170 |
Треонин Тhr,Тре |
172 |
129 |
Орнитин |
227 |
184 |
Цис |
174 |
131 |
Тир |
234 |
191 |
Асп |
186 |
143 |
Лиз |
241 |
198 |
Триптоф Три,Тгр |
257 |
214 |
Остатки лейцина и изолейцина в масс-спектре неразличимы.
Аминокислотная последовательность начинается в них с остатка той кислоты, в которой произошел разрыв связи С-N. Массы N-концевых ионов пептидов, образующихся при разрыве непептидных связей С-N приведены ниже в таблице.
Массы N-концевых ионов, образующихся в результате разрыва непептидных C-N связей в пептидах
Ион а/к |
Масса |
Ион а/к |
Масса |
Асп, Asp |
113 |
Гис, His |
135 |
Асн, Asn |
126 |
Тир, Tyr |
161 |
Фен, Phe |
131 |
Три, Trp |
184 |
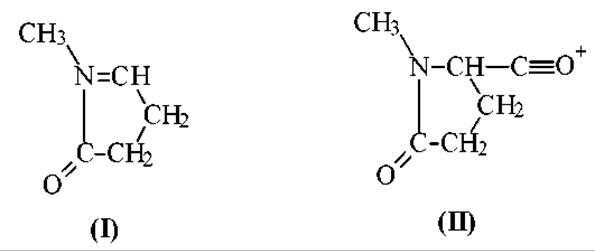
Остатки глутаминовой кислоты и глутамина, независимо от положения в пептидной цепи, часто циклизуются, образуя ионы N-концевой пирролидон- карбоновой кислоты. Эта циклизация приводит к появлению в спектре иона (I)
с массовым числом - 98. Соответствующий ему N-концевой ион (II) с m/z = 126 либо вообще отсутствует в спектре, либо проявляется пиком малой интенсивности:
Распад боковых цепей некоторых аминокислотных остатков протекает специфично. Это облегчает интерпретацию масс-спектров пептидов. Так, например, боковые цепи серина и треонина склонны к элиминированию молекулы этанола. Для треонина характерен отрыв всей боковой цепи (разрыв по С-С связи с миграцией Н-атома или без). Метионин склонен к выбросу молекулы СН3SН (m/z = 48) или всей боковой цепи.