Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Структура белков
Установление структуры С-концевых остатков пептидных цепей
Секвенирование пептидной цепи начинают с установления структуры концевых аминокислот. В линейном (цепочечном) пептиде таких аминокислот всего две на каждую макромолекулу. Это N- и C-концевые аминокислоты. В белках с разветвленной пептидной цепью их может быть больше. Для определения С-концевого остатка используют следующие приемы.
> Обрабатывают белок (пептид) гидразином. Он реагирует с карбонильной группой каждой пептидной связи, расщепляя ее с образованием ацилгидразидных производных всех аминокислотных остатков за исключением С-концевого. С-концевой остаток не подвергается модификации, поскольку его а-СООН группа не входит в пептидную связь.
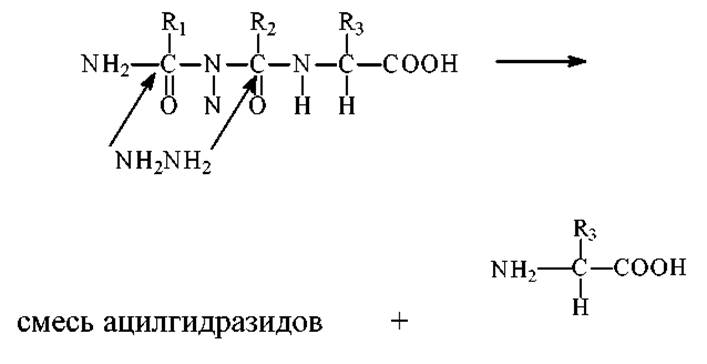
Для идентификации С-концевую а-аминокислоту (кислоты) экстрагируют из смеси ацилгидразидов и устанавливают ее структуру методами физикохимического анализа. Можно использовать и другой прием. Обработать раствор бензальдегидом. Он образует с ацилгидразидами нерастворимые в воде основания Шиффа, которые выпадают в осадок, а свободные аминокислоты остаются в растворе.
> Ферментативное отщепление С-концевой аминокислоты с помощью карбоксипептидазы - пищеварительного фермента, выделяемого из желудочного сока млекопитающих. Этот фермент избирательно отщепляет С-концевые остатки в пептидных цепях. Для установления структуры С-концевой аминокислоты этим способом исследуют кинетику процесса накопления образовавшихся в процессе ферментативного расщепления аминокислот в продуктах реакции. Поскольку фермент отщепляет все концевые аминокислоты (не только те, что имеются в исходном белке, но и вновь образующиеся после отщепления), то определить структуру С-концевой аминокислоты в исходной пептидной цепи можно по скорости ее накопления или по количеству образовавшейся аминокислоты в начальный момент времени. В идеальном случае с максимальной скоростью будет накапливаться аминокислота, являющаяся С-концевой в исходном белке (концентрация максимальна). С меньшими скоростями будут накапливаться вторая со стороны С-конца, третья и т.д. аминокислоты.
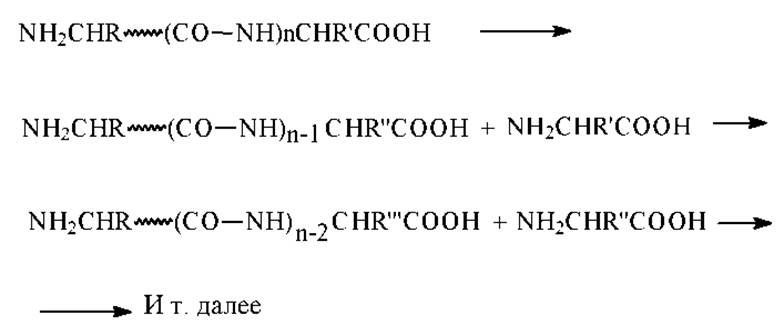
Таким образом удается установить последовательность из нескольких (до 10 и более) аминокислотных остатков в пептидной цепи со стороны ее С-концевой аминокислоты.
Метод был предложен Ленсоном в 1949г. Он имеет ряд недостатков, которые часто затрудняют установление структуры С-концевых аминокислот. Основными среди этих недостатков есть.
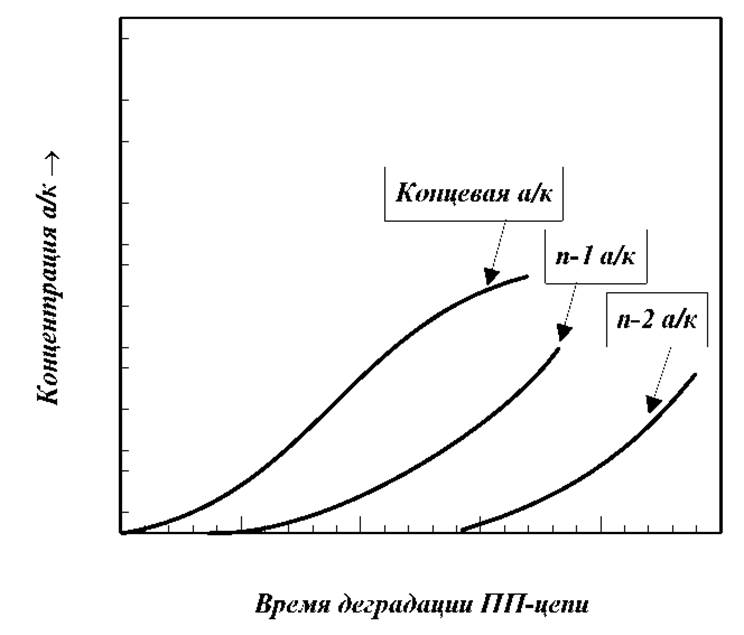
> Различия в скоростях отщепления разных аминокислот при прочих равных условиях. Наиболее легко отщепляются ароматические, затем следуют аминокислоты с длинной алифатической цепью и затем с короткой цепью.
> Очень медленно отщепляются дикарбоновые и диаминовые аминокислоты.
> Совсем не отщепляются пролин и оксипролин.
> Скорость отщепления зависит от структуры предконцевой аминокислоты и общей структуры молекулы белка.
Все это требует в ряде случаев дополнительной проверки полученных карбоксипептидазным методом данных. Так например, если фермент не отщепляет С-концевую аминокислоту, то нельзя сказать блокирована она или это пролин (оксипролин).