Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Пространственная структура белков
Домены в белках
Молекулы белков с большой ММ (более 14-16 кДа) склонны формироваться в относительно независимые глобулы, составленные из отдельных участков пептидной цепи. Каждая из этих глобул имеет свое гидрофобное ядро, окруженное мозаичной поверхностью гидрофобных и гидрофильных элементов цепи. Эти структурные образования внутри одной и той же молекулы белка названы доменами.
Домены определяют как области третичной структуры, которым присуща определенная анатомия структурной организации. Молекулу белка часто удается расчленить на отдельные домены, подвергнув ее частичному гидролизу.
Помимо структурной организации, домены нередко различаются своими биологическими функциями, т.е. обладают функциональной специфичностью. Например, нуклеотидсвязывающий домен дегидрогеназ, независимо от функции фермента и способа укладки его пептидной цепи, отвечает за связывание с коферментом NAD или NADH. Аминоконцевые домены (криглы) ферментов системы свертывания крови, обеспечивают связывания с липидами мембраны и другими белками. Аминоконцевые домены иммуноглобулинов содержат центр связывания антигена и т. д.
Однозначно определить функциональную роль отдельных доменов удается, однако, далеко не всегда. Например, молекула протеолитического фермента папаина содержит два хорошо различимых домена, однако функциональная направленность каждого из них пока не ясна (см рис. 2.5).
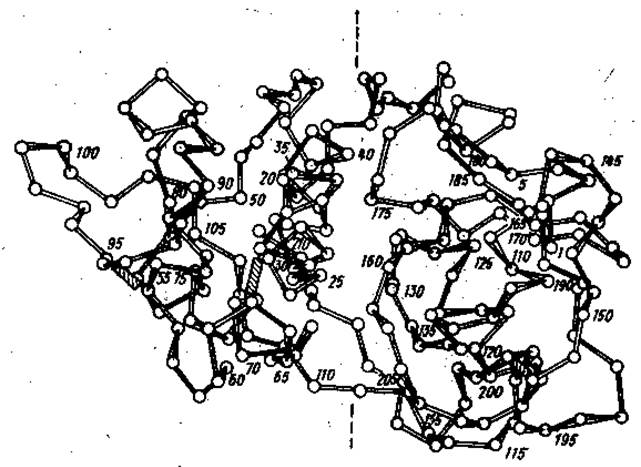
Рис. 2.5 Домены в пептидной цепи протеолитического фермента папаина
Домены формируются чаще всего автономным свертыванием последовательно расположенных участков пептидной цепи. Известны, однако, случаи формирования доменов и далеко отстоящими друг от друга отрезками участками одной и той же молекулы.
Предполагают, что домены относятся к раннему этапу эволюции пространственной структуры белков, которые образовались из менее крупных глобул. Например, маленькая молекула протеазы вируса иммунодифицита человека (ВИЧ) имеет пептидную цепь, состоящую из 99 аминокислотных остатков. Она имеет два домена и по структуре этих доменов очень сходна с протеазой пепсином. Эти две протеазы весьма сходны и по своему действию. Предполагают, поэтому, что протеаза ВИЧ является более ранним предшественником пепсина.
По устоявшемуся мнению домены - есть промежуточный подуровень структурной организации белка на пути от вторичной к третичной структуре. Не исключено, что процесс упаковки молекулы белка в третичную структуру включает стадию формирования доменов.