Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Аминокислоты
Аминокислоты
Классификация аминокислот
По химической структуре группы R аминокислоты подразделяются на:
1. алифатические;
2. гидроксилсодержащие;
3. серосодержащие;
4. ароматические;
5. кислые и амиды;
6. основные;
7. иминокислоты.
Алифатические аминокислоты


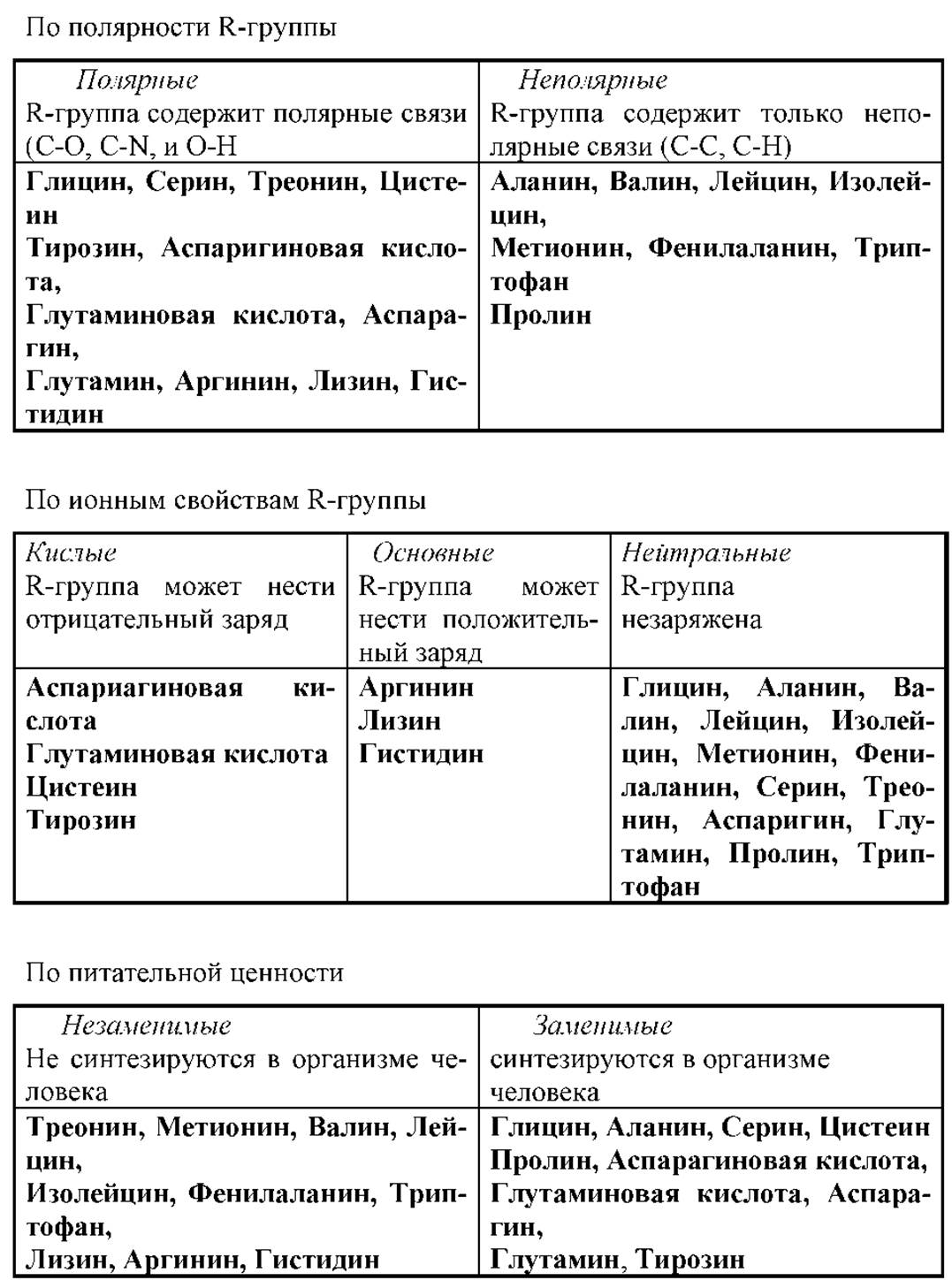
Аминокислоты с неполярными R-группами хуже растворяются в воде. Это аминокислоты с алифатическими радикалами: аланин, валин, лейцин, изолейцин. К ним же можно отнести фенилаланин, триптофан и метионин.
Полярность гидроксилсодержащих аминокислот обусловлена наличием в них большого дипольного момента и способностью ОН-групп образовывать водородные связи. Все полярные аминокислоты хорошо растворимы в воде.
Гидроксильная группа в тирозине ведет себя скорее как неполярная из-за наличия фенильного кольца.
Глицин и пролин - особые аминокислоты. Их структура значительно отличается от остальных а-аминокислот. Глицин не имеет асимметричного (хирального) атома углерода и не является, поэтому оптически активным соединением. Пролин - иминокислота, поэтому ее конформационные параметры отличаются от всех остальных R-остатков. В белках пролин ведет себя чаще как неполярный остаток.
Редкие аминокислоты белков
Помимо рассмотренных выше 20 наиболее распространенных аминокислот из гидролизатов некоторых специализированных белков выделены некоторые другие аминокислоты. Все они являются, как правило, производными обычных аминокислот, т.е. модифицированными аминокислотами.
Примеры некоторых из них.

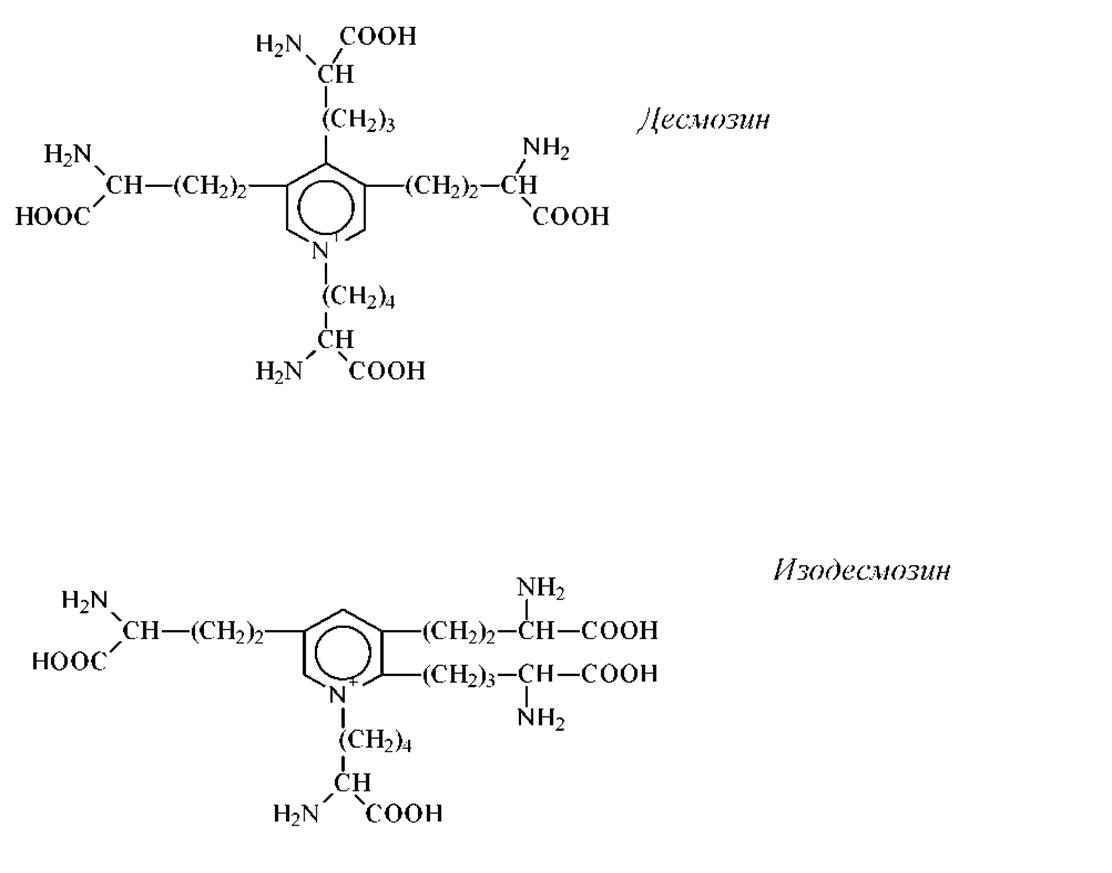
Десмозин и изодесмозин выделены из гидролизатов фибриллярного белка эластина. Похоже, что эти аминокислоты содержаться только в этом белке. Структура их необычна: 4-е молекулы лизина, соединенные своими R-группами, образуют замещенное пиридиновое кольцо. Возможно, что благодаря именно такой структуре эти аминокислоты могут образовывать 4-е радиально расходящиеся пептидные цепи. Результатом есть то, что эластин, в отличие от других фибриллярных белков, способен деформироваться (растягиваться) в двух взаимно перпендикулярных направлениях.
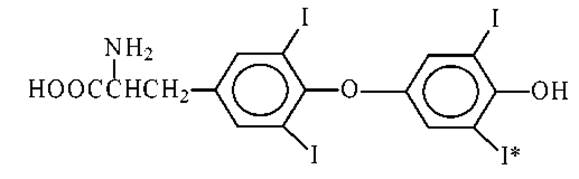
Тироксин (Т4, Т3) - тетра(три)иодотиронин
Т4 и Т3 (если I* замещен на Н) - иодсодержащие аминокислоты, которые синтезируются из тирозина в щитовидной железе. Они являются важными гормонами, регулирующими процессы роста и развития организма.
Аминокислоты не встречающиеся в белках
Таких аминокислот известно около 150. Большая часть из них являются производными а-аминокислот, содержащихся в белках. Встречаются также ß-, у- и δ-аминокислоты. Кроме того они могут иметь как L-, так и D-конформацию. Пример - D-глутаминовая кислота, обнаруженная в клеточных стенках бактерий. Некоторые аминокислоты этой группы играют роль важнейших предшественников или промежуточных продуктов метаболизма. Например, ß-аланин служит предшественником пантотеновой кислоты (витамина), а цитрулин и орнитин (см. структуры ниже) - промежуточные продукты синтеза аргинина: Орнитин + СО2 + NH3→ цитрулин (+NH3) → аргинин → мочевина + орнитин.
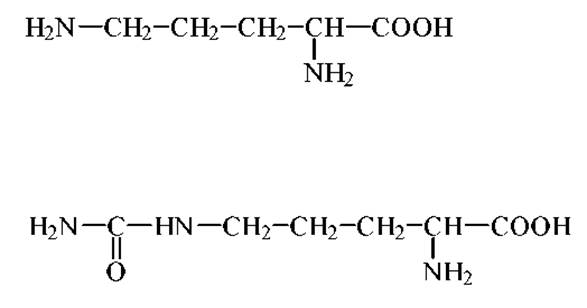
у-Аминомасляная кислота является продуктом декарбоксилирования глутаминовой кислоты. Она функционирует как химический агент в передаче нервных импульсов.
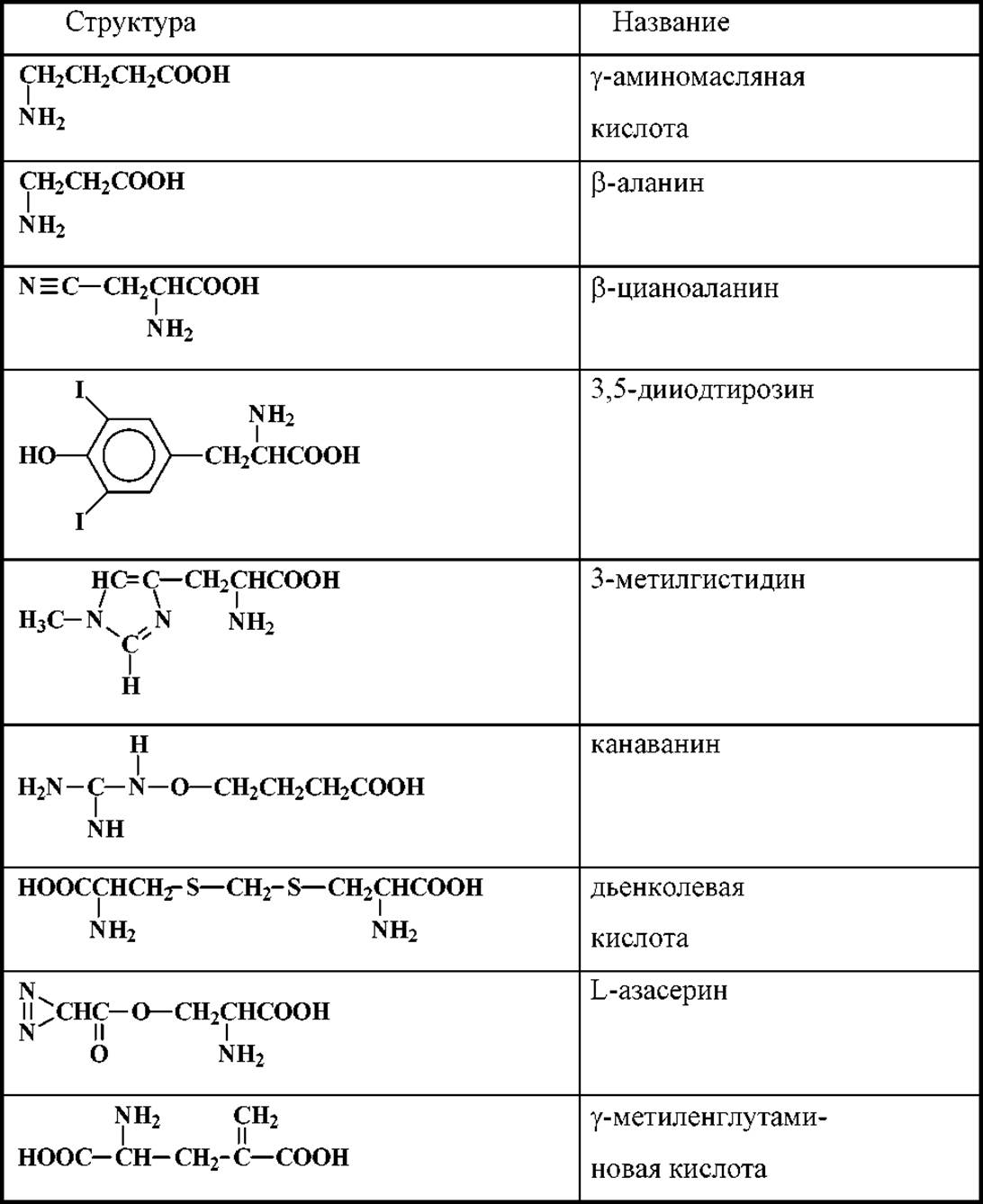
Ряд небелковых аминокислот растительного происхождения, например канаванин, дьенколевая кислота, ß-цианоаланин, токсичны для других форм жизни. Для примера структуры некоторых из этих аминокислот приведены в таблице 1.1
Таблица 1.1 Структура некоторых небелковых аминокислот.