Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Аминокислоты
Аминокислоты
Электронные спектры поглощения и кислотно-основные свойства аминокислот в растворах - Буферные системы. Уравнение Гендерсона-Хассельбальха
Буферная система - это раствор, который препятствует изменению концентрации ионов водорода при добавлении к нему кислоты или щелочи. Или - это раствор, который способен поддерживать, в известных пределах, постоянное значение рН при введении доноров Н+ (кислот) или акцепторов Н+ (оснований). Буферные свойства поддерживаются в растворах присутствием в них сопряженной кислотно-основной пары. Величину буферного действия характеризуют буферной емкостью ß. Она оценивается как количество сильного основания (щелочи), которое необходимо добавить к раствору для изменения его рН на единицу:
Простейшие широко распространенные в лабораторной химической практике буферные растворы включают в себя, как правило, компоненты слабых минеральных или органических кислот (кислота и соль этой кислоты, соли многоосновных кислот различной степени замещения и т.д.).
Буферные смеси применяемые для биохимических исследований должны удовлетворять следующим требованиям:
> обладать достаточной буферной емкостью;
> обладать достаточной степенью чистоты;
> хорошо растворятся в воде и не проникать через биологические мембраны;
> быть устойчивыми к действию ферментов;
> не оказывать токсического и ингибирующего действия;
> не поглощать свет в видимой и УФ-областях.
Механизм действия буферных смесей. рН растворов кислот и оснований
Рассмотрим самый общий случай. Кислота (HA), отщепляя при диссоциации протон, переходит в сопряженное основание (А-):
![]()
Пара ![]() представляет собой таким образом сопряженную пару: кислота - основание.
представляет собой таким образом сопряженную пару: кислота - основание.
Для одноосновных сильных кислот (сильных электролитов) в разбавленных растворах концентрацию ионов водорода можно принять равной исходной аналитической концентрации кислоты (Сk). Соответственно рН растворов сильных кислот выражают как:
рН = -lgCk
а рН растворов сильных оснований как:
рН = 14 - lgCk
Слабая кислота в растворе диисоциирует не полностью (частично). Константа равновесия процесса диссоциации в соответствии с законом действия масс выразится в этом случае следующим образом:
![]()
Условие общей электронейтральности раствора можно записать так:
[A-] + [HO-] = [H+]
В водных растворах обычно выполняется неравенство:
[HO-]<<[A-]
т.е. условие общей электронейтральности можно выразить следующим образом:
[A-] ≌ [H+]
С учетом последнего, выражение для Ка примет вид:
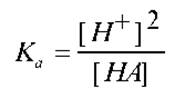
Здесь [HA] есть, как и везде выше, не аналитическая концентрация кислоты, а ее равновесная концентрация. Она естественно меньше исходной концентрации С, поскольку кислота частично продиссоциировала на ионы. Количество распавшейся на ионы кислоты определится как:
[HA] = Сk - [H+]
Тогда, для Ка получим:
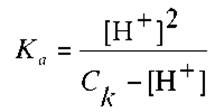
Решив последнее уравнение относительно [H+], будем иметь:
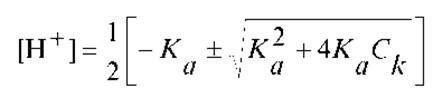
Для слабых кислот справедливо неравенство:
Сk >> [H+]
и для Ka можно ограничиться приближенным и менее громоздким выражением:
K = [H+]2/Ck
Откуда:
![]()
Или:
pH = (pKa - lgCk)/2
Соответственно, для слабодиссоциирующих оснований:
pH = (14 + pKa + lgC)/2
где рКа -константа диссоциации сопряженной к основанию кислоты.
рН растворов сильных кислот в присутствии сильных оснований
Величина рН таких растворов рассчитывается по той же, примерно, схеме, что и выше. Отличие только в том, что условие электронейтральности раствора нужно дополнить концентрацией катиона сильного основания (М+):
[M+] + [H+] = [A-] + [OH-] = [A-],
Поскольку в применяемых на практике водных растворах очень часто выполняется неравенство:
[A-] >> [HO-],
Для сильного основания допустимо приближение:
[M+] ≌ [MOH] ≌ Co
где Со - аналитическая (исходная) концентрация сильного основания.
С учетом принятых допущений, для Ка будем иметь:
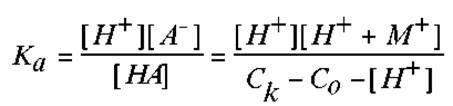
В данном случае, для нахождения равновесной концентрации кислоты [HA], из ее аналитической концентрации вычитаются концентрации ионов водорода, образовавшихся в результате диссоциации кислоты, и аналитическая концентрация щелочи. Она уменьшает количество кислоты за счет реакции нейтрализации.
Приближения:
Ck >> [H+] и Co >> [H+]
остаются в силе. Тогда
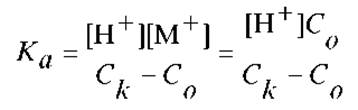
После логарифмирования, получим:
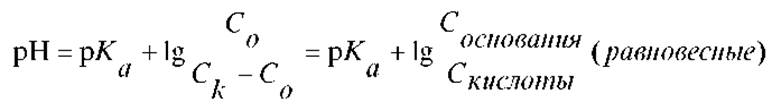
Это уравнение называется уравнением Гендерсона-Хассельбальха. Из него следует, что рКа есть величина рН, при котором половина молекул кислоты в растворе находится в диссоциированном состоянии.
Экспериментально, величину рКа можно легко определить методом потенциометрического титрования, результат которого выражают в виде зависимости рН среды от количества введенных в раствор эквивалентов НО- - ионов (см.рис. ниже)
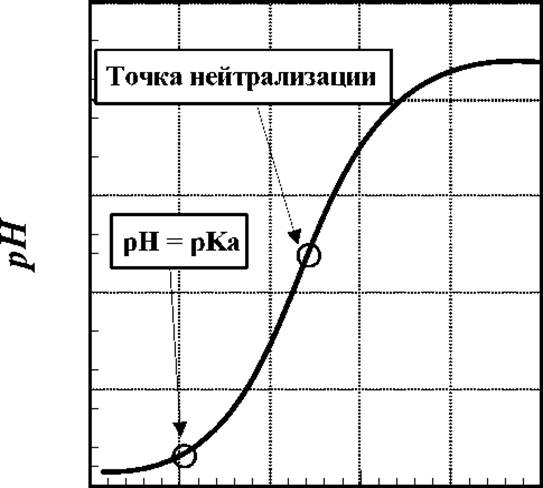
Количество эквивалентов ОН
Первая точка перегиба (в нижней части кривой) и есть точка, в которой рН = рКа. Из рисунка видно, что в окрестности этой точки добавление щелочи к раствору незначительно изменяет величину рН, т.е. наблюдается буферный эффект. Таким образом, буферная емкость раствора максимальна при значении рН = рКа.
Рассмотрим теперь на конкретном примере, как “работает” буферная система. Пусть мы имеем в растворе сопряженную кислотно-основную пару: Н2РО4-/НРО42-. При добавлении к такому раствору ионов Н они будут связываться акцептором протонов (сопряженным основанием) - НРО42-, что приведет к уменьшению величины отношения: Н2РО4-/НРО42-. И наоборот, при введении ионов НО- это отношение будет увеличиваться, поскольку Н2РО4- будет выступать донором протонов для связывания НО- в молекулы воды. Если исходная буферная смесь содержит кислоту и сопряженное ей основание в эквимолярных количествах, то рН раствора = рКа для данной пары (см. уравнение Гендерсона-Хассельбальха). И для того, чтобы рН изменилось на 1 необходимо, чтобы отношение Н2РО4-/НРО42- изменилось (уменьшилось, увеличилось) в 10 раз. Много это или мало?
Пусть мы имеем эквимолярную смесь Н2РО4-/НРО42- с концентрацией обоих компонентов по 0.1 М. Если ввести в нее 0.01 М ионов НО-, то lg([HPO42-]/[H2PO4-]) (а соответственно и рН раствора) увеличиться примерно на 0.05 единицы. В то же время, рН 0.01 М раствора щелочи = 12, т.е. при растворении 0.01 М щелочи просто в воде рН полученного раствора возрастет на 5 единиц (рН = 12 - 7).
Эффективность буферной системы, т.е. способность сохранять величину рН раствора максимальна при эквимолярных соотношениях кислота-основание. Принято считать, что раствор может выполнять буферные функции в области: lg([A-]/[HA]) = ± 1.
В клетках, и организме в целом, физиологические значения рН поддерживаются аминокислотами, нуклеотидами, белками, нуклеиновыми кислотами, липидами и рядом других биомолекул, которые способны существовать в сопряженных кислотно-основных формах.