Принципы структурной организации белков - Г. Шульц 1982
Структурная роль пептидной связи
Цис- и транс-конфигурации
Одна из альтернатив должна быть универсальной. До сих пор мы предполагали, что все пептидные связи находятся в транс-, а не в цис-конфигурации (рис. 2.1, б). Очевидно, что пептидный синтез на рибосомах стереоспецифичен и поэтому должен приводить либо к цис-, либо к транс-связям. В любом случае одна из альтернатив должна быть универсальной, иначе механизм синтеза и генетический код усложнились бы, что неблагоприятно с организационной точки зрения. Точно так же невыгодна и пост-трансляционная изомеризация, поскольку для этого потребовалось бы много специальных ферментов. Спонтанная изомеризация в процессе свертывания полипептидной цепи также невозможна, поскольку энергетический барьер между транс- и цис-конфигурациями составляет ~20 ккал/моль. Этот барьер ниже только для остатка Pro, для которого изменения геометрии пирролидинового цикла снижают барьер до 13 ккал/моль. В процессе свертывания остатки Pro могут претерпевать спонтанную изомеризацию (разд. 8.2). Энергетическое различие между цис- и транс-изомерами составляет ~2 ккал/моль в пользу транс-изомера; это различие меньше всего для Pro, поскольку для него переход от транс- к цис-изомеру приводит к замене контакта между атомами Саі и Cаі+1 всего лишь аналогичным контактом между атомами Cаі и Сδі+1 (рис. 1.1).
В глобулярных белках найдены несколько цис-пептидов. цис-Связи обнаружены во многих циклических пептидах, в особенности со стороны N-конца перед остатками Pro [37, 38]. В глобулярных белковых структурах обнаружено только несколько цис-связей, например перед Рrо-93 и Pro-114 в рибонуклеазе S [39], перед Рrо-168 в субтилизине [40], перед Pro-116 в нуклеазе стафилококка [Е. Хазен, частное сообщение], перед Рrо-8 и Рrо-95 вариабельной цепи белка Бенс-Джонса [42] и между Ser-197 и Туr-198 в карбоксипептидазе-А [43]. Молекулы синтетического поли-L-Pro I содержат только цис-связи. Таким образом, из всех типов стандартных аминокислот Pro в наибольшей мере способствует образованию цис-связи, что согласуется с энергетическими расчетами. Однако, как правило, цис-связи встречаются крайне редко.
В случае реализации полностью цис-белка конформационная свобода была бы чрезмерно ограничена. Если есть необходимость в одном универсальном изомере, то почему выбран транс-, а не цис-изомер? Убедительным аргументом в пользу транс-изомера служит строгое ограничение разрешенного конформационного пространства в полностью цис-полипептидной цепи. Для изолированного Са-атома стерические затруднения в случае цис- и транс-изомеров не отличаются. Однако для гипотетической полностью цис-полипептидной цепи отталкивание между соседними боковыми цепями резко возрастает. Это показано на рис. 2.6 для поли-L-циc-Ala. Цепь в этом случае образует резкие изгибы, сближая соседние Са-атомы.
Рамачандран и Сасисекхаран [29] попытались найти конформации, разрешенные для такой цепи. В предположении модели жестких сфер с нормальными контактными радиусами они обнаружили только очень небольшую разрешенную область при (—155°, +105°). Даже для модели жестких сфер с радиусами, отвечающими нижним границам, разрешенная область оказалась очень малой, что можно видеть на рис. 2.3, б. В отличие от цепей, состоящих только из цис-пептидных групп, в случае транс-конфигурации разрешенные конформационные состояния цепи оказываются достаточными для образования множества глобулярных белков. С другой стороны, цепи со всеми транс-пептидными группами являются в меру жесткими, так что спонтанное свертывание не требует значительных усилий стягивания различных участков белка (разд. 3.5). Отметим в этой связи, что энергетическая предпочтительность в 2 ккал/моль транс-изомера по сравнению с цис-изомером не представляется существенной, поскольку цепь с пептидными группами в цис-конфигурации должна быть более жесткой и, следовательно, не требовать при формировании уникальной конформации белка такой же большой энергии связывания, как цепь с пептидными группами в транс-конфигурации.
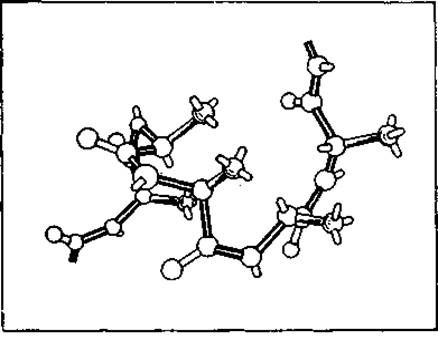
Рис. 2.6. Поли-L-цис-аланин. Углы (—, ψ) отмечены значком х на рис. 2.3, б. Конформация разрешена в предположении модели жестких сфер с контактными радиусами, отвечающими нижним границам (табл. 2.1).