Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия белок - лиганд
Центры связывания гема
Химические превращении атома железа гема в микросреде белка
В гемоглобине ион Fe2+ защищен от окисления неполярным окружением. Полипептидная цепь гемсодержащего белка создает для его простетических групп особую микросреду, которая способствует определенному химическому превращению и препятствует протеканию других реакций. Важную роль микросреды демонстрирует пример гемоглобинов. В воде феррогем связывает O2, но при этом сразу же окисляется до ферригема, который не способен присоединять молекулярный кислород [637]. Однако гем может обратимо присоединять кислород и без окисления, если он заключен в неполярную среду, например бензол, где значительно труднее оттянуть электрон от ферроиона, чем в воде [639, 647]. Можно заключить, что основное назначение неполярного гемсвязывающего кармана — это предохранение ферросостояния гема от окисления путем его защиты от воды.
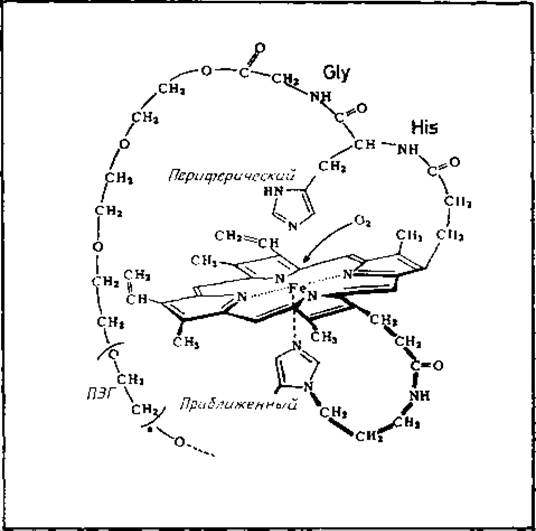
Рис. 10.2. Химический аналог активного центра гемоглобина [727].
В центре схемы находится протогем IX. Одна пропионовая боковая цепь (вверху справа) образует пептидную связь с аналогом периферического His гемоглобина, который связан с полиэтиленгликолем (ПЭГ) через остаток Gly. Другая пропионовая группа (внизу справа) связана через разделительную цепь с имидазолом, который представляет аналог приближенного His. Химический переносчик О2 качественно сходен с гемоглобином по характеру обратимого связывания молекулярного кислорода и по некоторым спектральным свойствам.
Химическая модель соединений, обладающих активностью гемоглобина. Синтез модели активного центра гемоглобинов основан на идее замены белка другим полимером [639, 727] (рис. 10.2) или присоединенными к гему гидрофобными боковыми цепями, образующими «частокол» [797]. Модельные системы такого типа могут быть полезными при выяснении взаимосвязи структура — функция природных макромолекул. Кроме того, они позволяют экстраполировать принципы структурной организации белков к условиям, которые несовместимы с функциональной целостностью самих белков (необычные значения температуры, pH и состава растворителя).
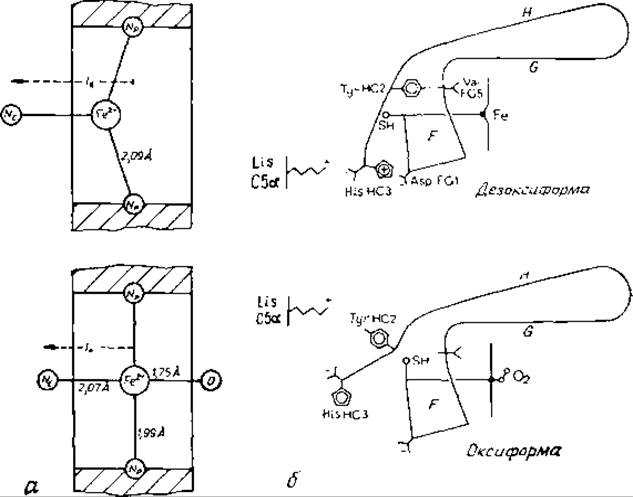
Рис. 10.3. Изменение гемоглобина при окислении. а — возможные положения иона железа относительно плоскости порфиринового цикла (заштрихована) в дезоксигемоглобине [804, 654] и в оксигемоглобине [550, 651]. Расстояния центр — центр взяты из работ, цитированных Филипсом [690]. Следует отметить, что геометрия гема в оксигемоглобине установлена по так называемым частокольным комплексам [651], т. е. по модельным соединениям. Указаны положения двух порфириновых атомов азота (Np) и атома Nε приближенного His. При окислении атом Nε смещается на Іd—І0 = 0,6±0,1 Å. б — коиформационные изменения в субъединице гемоглобина при окнслеиин (Перутц, частное сообщение). Смещение спирали F к спирали Н приводит к вытеснению предпоследнего остатка ß-субъединнцы Туг НС2 из кармана между двумя спиралями. При этом радикально меняется положение карбоксильной группы концевого остатка His НС3; Val FG5 — это VaI-98.
О2 и СО присоединяются к гемоглобину как изогнутые лиганды. Этот способ присоединения, по-видимому, входит в механизм дискриминации СО. Сродство гемоглобинов к О2 в два раза ниже, чем у простых железопорфириновых моделей, например гема, растворенного в бензоле. По способности к связыванию СО обе системы различаются в 100 раз [648]. Следовательно, образованная белком микросреда дискриминирует СО, не изменяя заметно своей способности к связыванию О2. Эта селективность основана отчасти на различии для СО и О2 электронного влияния, связанного с транс-расположением второго аксиального лиганда атома железа [649] так называемого приближенного His (рис. 10.2).
Однако более важным представляется другой аспект. И в простой железопорфириновой системе [650, 651], ив гемоглобине [690] молекулярный кислород связан в виде изогнутого лиганда (рис. 10.3, а), а в такой форме он наилучшим образом может быть описан как пероксид О-2 ([652, 653], ср., однако, [650]). Напротив, СО в простой системе связывается по линейному типу [648, 654], а во всех до сих пор изученных гемоглобинах — по изогнутому [655—657]. Таким образом, белковая среда, в которой находится гем, определяет способ связывания, который благоприятен для О2 и неблагоприятен для СО. Необходимо упомянуть, что, несмотря на такую дискриминацию, сродство гемоглобинов к СО все-таки в 500 раз выше, чем к О2 [634].
Эволюция связывания лиганда в направлении, неблагоприятном для СО, по-видимому, была обращена против эндогенного СО, который выделяется при разложении порфирина в пигменты желчи [85]. Если бы не такая предосторожность, образующийся СО мог бы занять примерно одну треть всех мест связывания гемоглобина [649]. Современная точка зрения на дискриминацию в отношении СО заключается в том, что появившиеся более чем 108 лет назад гемо глобины подверглись адаптации к условиям, которые в ином случае могли оказаться смертельными, — курению табака и загрязнению воздуха.
В цитохромах атом железа гема защищен от нежелательных лигандов. В цитохромах белковая микросреда выполняет две функции: защищает гем от нежелательных лигандов и поддерживает на нужном уровне окислительно-восстановительный потенциал атома железа. Было высказано предположение о защитной роли Met-80, который координирует атом железа гема в цитохроме с (рис. 7.8) [509]. В отсутствие такого контакта атом железа легко и неконтролируемо восстанавливается, например аскорбатом [658]. Можно утверждать, что полипептидная цепь гарантирует правильность транспорта электрона по его биологическому пути [509]. Необычна инертность к лиганду иона железа в цитохроме b5 [297]; по-видимому, она связана с жесткостью аксиальных лигандов (разд. 10.3).
Окислительно-восстановительный потенциал атома железа гема в цитохроме с определяется аксиальными лигандами. Влияние апобелка на уровень окислительно-восстановительного потенциала исследовали Мур и Вильямс [659]. В этой работе были сопоставлены окислительно-восстановительные потенциалы соединений, моделирующих гем [660], а также использована структурная информация о различных цитохромах и данные метода ядерного магнитного резонанса для отдаленно родственных цитохромов с. В результате авторы пришли к выводу, что окислительно-восстановительный потенциал атома железа гема определяют аксиальные лиганды. Так, две- гистидиновые боковые цепи в качестве аксиальных лигандов, обнаруженные, например, в b5, обеспечивают более низкий окислительно-восстановительный потенциал, чем пара гистидин — метионин, обычно присутствующая в цитохромах с. Если сравнивать цитохромы с, то обнаруживаются вариации длины связи Fe—S [659]. Укорочение этой связи на 0,1 Å связано с уменьшением оксилительно-восстановительного потенциала на 400 мэВ, что отражает увеличение-электронодонорной способности атома серы метионина.