Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия белок - лиганд
Центры связывания гема
Лиганды гема как пусковые системы структурных изменений гемоглобина млекопитающих
Дезоксигемоглобин содержит высокоспиновый ион Fe2+, а оксигемоглобин — низкоспиновый ион Fe2+. До сих пор существуют разногласия по поводу конформационных изменений, происходящих в ходе окислительно-восстановительного цикла цитохрома с [459, 509, 564]. Поэтому мы ограничим обсуждение хорошо изученным случаем тетрамерного гемоглобина млекопитающих [60, 662, 666].
Кристаллографические исследования показали, что четвертичные структуры окси- и дезоксиформ гемоглобина существенно различаются. Эти различия указаны в табл. 10.1. В частности, при окислении четыре субъединицы смещаются относительно друг друга, в результате чего расстояние между атомами железа ß-цепей уменьшается на 6,5 Å. Такое значительное изменение четвертичной структуры, вероятно, основано на чисто химических аспектах взаимодействий железопорфиринов [637, 663, 664]. В железопорфириновом комплексе возможны два типа распределения d-электронов. Высокоспиновая конфигурация, найденная в дезоксигемоглобине, характеризуется большим числом орбиталей с неспаренными электронами, чем низкоспиновая конфигурация оксигемоглобина. Одно из последствий состоит в том, что высокоспиновый атом железа имеет слишком большой размер для того, чтобы оставаться в плоскости порфиринового цикла, и выходит из нее на 0,5 Å [550] (рис. 10.3).
Механизм присоединения O2 гемоглобином изучен на атомном уровне. Проследим теперь процесс насыщения дезоксигемоглобина кислородом [60, 550]. Молекулярный кислород подходит к высокоспиновому атому железа одной а-субъединицы (в ß-субъединицах дезоксигемоглобина шестое координационное место блокировано остатком Val-67 и не доступно для О2) и переводит его в низкоспиновую конфигурацию. В результате атом железа смещается на 0,5 Å и возвращается в плоскость порфиринового цикла. Имидазол (приближенного) гистидина, который координирует атом железа, передвигается на такое же расстояние или, возможно, даже на 0,7 Å, поскольку связь железо—аксиальный лиганд при переходе атома железа из высокоспинового в низкоспиновое ферросостояние укорачивается на величину от 0,1 до 0,2 Å.
Таблица 10.1 Различия между дезоксигемоглобином и оксигемоглобином [550, 666]
|
Дезоксигемоглобин |
Оксигемоглобин |
|
|
Шестое координационное место Fe+ |
Вакантно |
Занято |
|
Конфигурация d-электронов атома железа |
Высокоспиновая |
Низкоспиновая |
|
Длина связи между Fe2+ и атомом азота пиррола |
2,09 Å |
2,01 Å |
|
Смещение атома железа из плоскости порфиринового цикла |
0,75 Å |
0,05 Å |
|
Расстояние между ε-атомом азота координированного His и плоскостью порфирина |
2,67+0,1 Å |
2,07 Å |
|
Положение предпоследней боковой группы тирозина |
Между спиралью F и спиралью Н |
Удалены из этого положения (рис. 10.3,6) |
|
Положение терминальных карбоксильных групп |
Фиксировано электростатическим взаимодействием с другой субъединицей |
Имеет свободу вращения |
|
Расстояние между Fe2+ß1-субьединицы и β2-субъединицы |
39,8 Å |
33,4 Å |
|
Положение дифосфоглицерата |
Фиксирован между β1 и ß2-субъединицами |
Не связан |
|
Карман лиганда в 3-цепи |
Блокирован боковой цепью Val-67; может быть заполнен кислородом только в том случае, если будет раскрыт за счет тепловой энергии |
Содержит О2 |
Спираль F, к которой присоединяется приближенный His, так близко подходит к спирали Н, что боковая цепь предпоследнего остатка Туr уже не помещается между двумя спиралями и выталкивается, оттягивая С-концевой остаток, который удерживался солевым мостиком с другой a-цепью. Таким образом, нарушается главная связь, фиксирующая дезоксиформу (рис. 10.3, б). Присоединение О2 к следующей субъединице оказывает такое же действие на связь между субъединицами и усугубляет изменение четвертичной структуры. Одно из последствий этого изменения заключается в оттягивании остатка Val-67 от лигандного кармана ß-субъединиц, в результате чего их атомы железа также становятся доступны для О2. Энергетические аспекты этого перехода обсуждались несколькими авторами [60, 268, 634].
Пример дезоксигемоглобина показывает, почему бывает трудно распознать химическое взаимодействие, которое дает толчок решающим изменениям четвертичной или третичной структур белка: «запускающее» событие должно быть структурно незаметным. В случае гемоглобина потребовались многие годы, прежде чем удалось установить, что пусковой механизм связан с атомом железа, который приводит в движение субъединицы гемоглобина [666].
В тетрамерном гемоглобине сродство гема к О2 контролируется концентрациями О2, СО2, Н+ и 2,3-дифосфоглицерата. Что же было достигнуто в результате эволюции мономерного гемоглобина типа миоглобина в сложный гемоглобин млекопитающих? Основное преимущество заключается в возросшей физиологической приспособляемости тетрамерного белка, которая достигнута за счет постепенного перевода сродства к кислороду, свойственного центру связывания, под контроль внешних влияний [276, 549, 667] (рис. 10.4).
Одним из преимуществ является и улучшенный вариант эффекта Хальдана [668, 669], который заключается в освобождении протонов при присоединении молекулярного кислорода к гемоглобину, и наоборот. Этот эффект важен для транспорта молекулярного кислорода из легких к потребляющим кислород тканям, а также для транспорта протонов из этих тканей к легким. Кроме того, с помощью разных типов гемоглобина, которые имеют различную чувствительность к концентрации ионов водорода, некоторые типы рыб могут использовать О2 для двух раздельно контролируемых функций: для наполнения воздушного пузыря и для перевода молекулярного кислорода в пути метаболизма [136]. Большое значение имеет также возможность использования некоторых специальных органических фосфорильных соединений, таких, как 2,3-дифосфоглицерат (ДФГ) или инозитолгексафoсфат [670, 671], в качестве аллостерических эффекторов, благоприятствующих дезоксиконформации. Эти эффекторы играют решающую роль в переносе О2 из материнской крови в кровь плода [274, 671], при адаптации к большой высоте [672] и при заболеваниях, при которых артериальная кровь лишь частично насыщается кислородом [85, 673] (рис. 10.4).
Кооперативность субъединиц облегчает сложную задачу переноса О2. Еще одним важным фактором является так называемое взаимодействие гем — гем, т. е. влияние связанного с О2 гема на сродство к О2 групп гема других субъединиц [634]. Этот эффект дает возможность гемоглобину захватывать О2 в легких при концентрации свободного О2 130 мкМ и освобождать приблизительно 30% О2 в капиллярах тканей, потребляющих О2 (рис. 10.4). Здесь концентрация свободного O2 должна оставаться на уровне 50 мкМ (чтобы обеспечить диффузию кислорода в клетки ткани). Доля освобождаемого кислорода (30%) не очень сильно зависит от уменьшения концентрации O2 в легких и может быть увеличена за счет сокращения среднего диффузионного пути O2 в тканях. Напротив, переносчик с независимыми центрами связывания O2 освобождал бы при благоприятных условиях меньше 20% переносимого кислорода и не обладал бы возможностями к адаптации (рис. 10.4). Таким образом, кооперативность олигомера обеспечивает более высокую приспособленность к выполняемой функции.
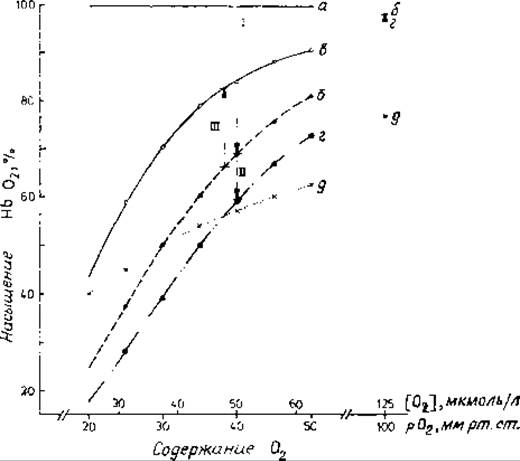
Рис. 10.4. Кривые связывания О2 гемоглобинами [85J.
Дана зависимость насыщения гемоглобина (Нb) кислородом при pH 7,2 от концентрации свободного кислорода. Концентрации O2 в капиллярах легких (125 мкМ) н в капиллярах тканей, потребляющих O2 (50 мкМ), зафиксированы в узких пределах. Кривая а: в отсутствие дифосфоглицерата (ДФГ) гемоглобин насыщается O2 в легких, но не может доставлять его к тканям. Кривая б: при физиологическом уровне ДФГ (4,5 мМ.) приблизительно 30% O2. поглощенного легкими, высвобождается в тканях (стрелка 1). Кривые б и в: поскольку гемоглобин плода (кривая в) имеет более низкое сродство к ДФГ. чем материнский гемоглобин, освобожденный из материнской крови молекулярный кислород может захватываться гемоглобином плода (стрелка IIІ). Кривая г: высокая концентрация ДФГ (8 мМ) приводит к повышенному снабжению тканей кислородом (стрелки I и II). Кривая д: при отсутствии кооператнвиости между субъединицами гемоглобина от легких к тканям транспортировалось бы меньше O2. При построении гипотетической кривой связывания (д) для комплекса НbO2 принята константа диссоциации 38 мкМ.
Многие представления о действии и взаимодействии белков появились в ходе исследования гемоглобина. Многие представления и модели, относящиеся к взаимодействиям белок — лиганд и белок — белок, были развиты в процессе исследований гемоглобина; к ним относятся сигмоидное связывание [674—676], коэффициент Хилла [677], константы последовательного связывания лигандов в олигомерных белках [678], кооперативность, основанная на конформационных изменениях [679, 680], и аллостерический контроль белков [92, 681, 682]. Следует отметить, что многие из этих концепций были введены и математически формализованы до того, как стала известна структура какого-либо белка. Очевидно поэтому актуальное значение и полезность этих концепций должны подвергаться постоянной проверке. Пример дифосфоглицерата, влияние которого на действие и структуру гемоглобина игнорировалось десятилетиями, свидетельствует о потенциальной опасности жестких формулировок в биологии.